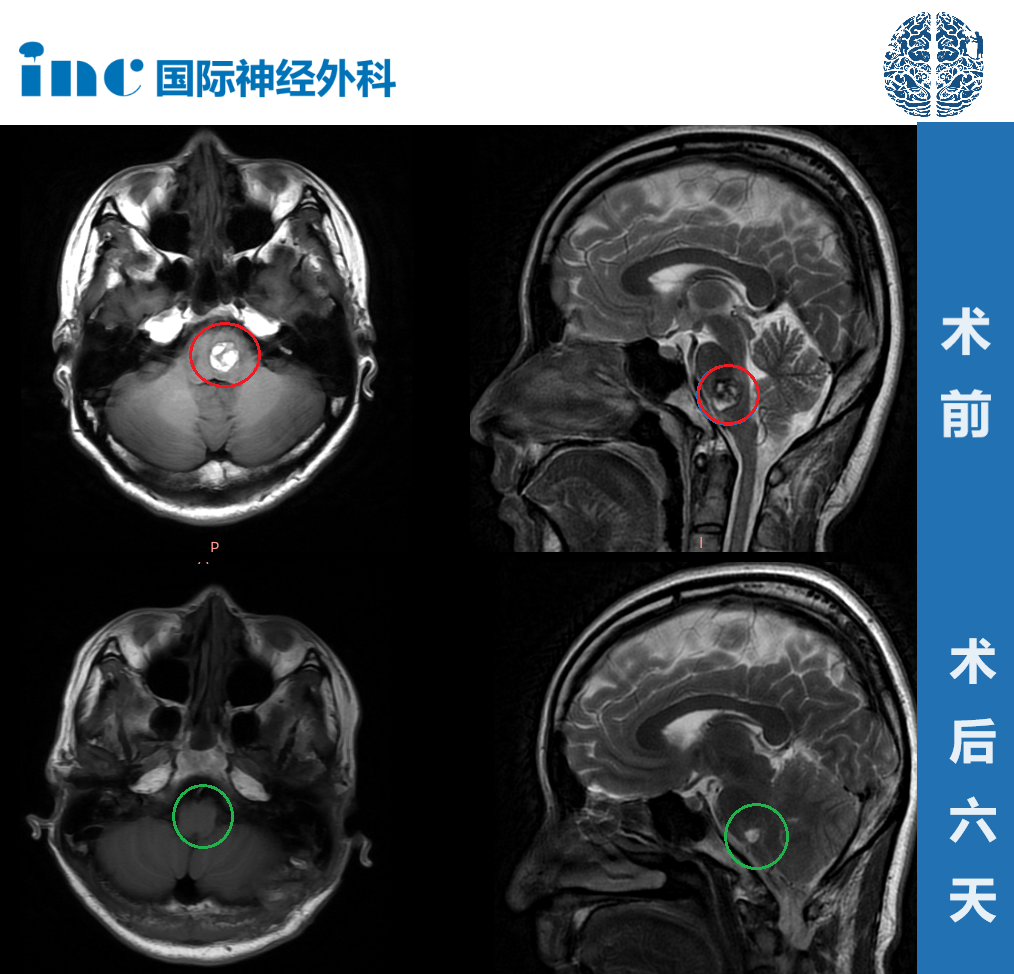
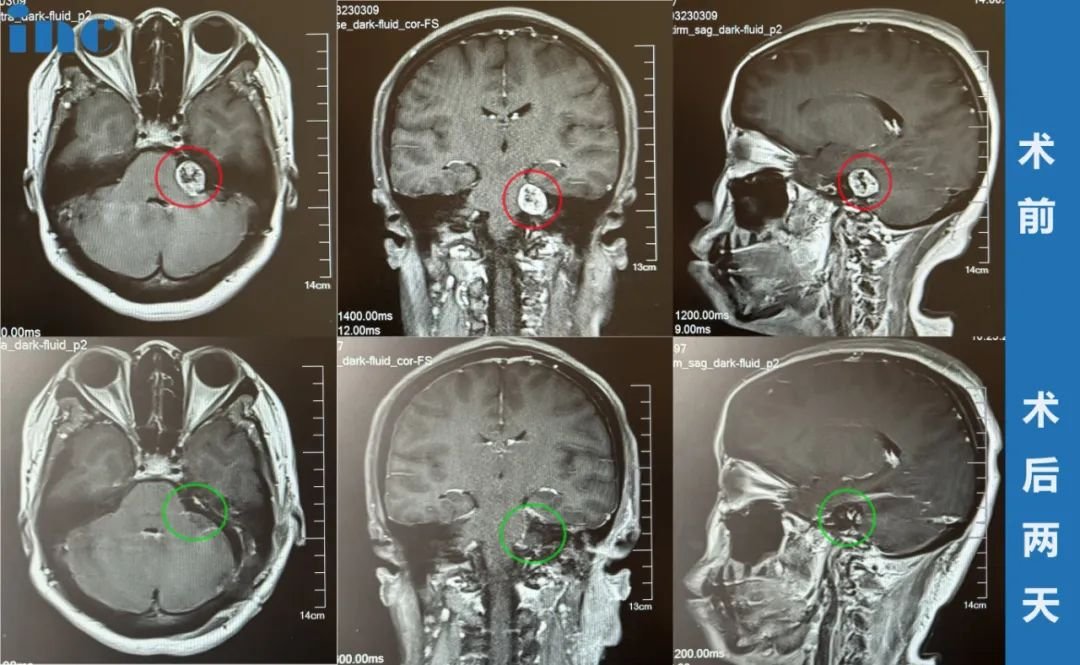
2024年春,48岁的中学教师陈敏突然发现看黑板时右侧视野模糊,起初以为是老花眼,直到某天过马路差点被车撞到——眼底检查显示视神经乳头水肿,进一步MRI发现左侧前床突区3cm脑膜瘤,像楔子般挤压视神经与颈内动脉。这个藏在颅底深处的肿瘤,正是导致她视力骤降的元凶。在上海瑞金医院神经外科,她接受了翼点入路显微手术,术后三个月视力恢复至1.0,MRI显示肿瘤全切。这个案例揭示了前床突脑膜瘤的典型特征:早期隐蔽、压迫性强,但通过精准诊断与手术,完全有可能实现根治。
一、前床突:颅底“神经血管十字路口”的致命占位
(一)解剖学核心:为什么这里肿瘤如此危险?
前床突是蝶骨小翼的突出部分,位于颅底中央区,毗邻三大关键结构:
视神经:肿瘤前上方紧贴视神经管,30%患者早期出现视力下降(如陈敏的视野缺损);
颈内动脉:75%肿瘤包绕颈内动脉海绵窦段,血管壁受压可引发脑缺血;
海绵窦:外侧与海绵窦相邻,侵犯时导致动眼神经麻痹(如眼睑下垂、复视)。
这种“三角区”占位如同在神经血管密集区放置炸弹,肿瘤每生长1cm,视神经萎缩风险增加40%,颈内动脉狭窄率上升35%(《Journal of Neurosurgery》2025数据)。
(二)病理特征:良性肿瘤的侵袭性表现
前床突脑膜瘤90%为WHOⅠ级良性肿瘤,但因血供丰富(由眼动脉、脑膜前动脉供血),常呈膨胀性生长:
钙化特征:25%病例CT可见点状钙化,MRI增强扫描呈均匀强化的“脑膜尾征”;
硬膜附着:基底宽且固定于前床突硬膜,导致肿瘤与周围结构粘连紧密,传统手术全切率曾不足60%。
二、早期预警:别把视力下降当“老花”
(一)三大典型症状:容易被忽视的危险信号
视力进行性下降(占70%):
陈敏的经历具有代表性:最初单眼模糊,3个月内矫正视力从1.2降至0.5,因肿瘤压迫视神经鞘导致轴浆运输障碍;
特征性表现:视野缺损呈“鼻侧偏盲”,即看东西时单侧鼻侧区域模糊,区别于老花眼的整体视物不清。
头痛与眼眶疼痛(占55%):
多为深部钝痛,因肿瘤刺激脑膜或压迫眶上神经,清晨或用力时加重,常被误诊为鼻窦炎。
眼球运动障碍(占30%):
侵犯海绵窦时累及动眼神经(Ⅲ)、滑车神经(Ⅳ),表现为眼球活动受限、复视,如患者看天花板时出现重影。
(二)误诊陷阱:从眼科到神经外科的转诊延误
约40%患者首诊于眼科,因眼底水肿、屈光改变被误诊为青光眼、视神经炎。陈敏的主治医生提醒:“当视力下降合并头痛,尤其是单侧症状,一定要做颅底MRI排查,别让前床突脑膜瘤成为‘眼科漏网之鱼’。”
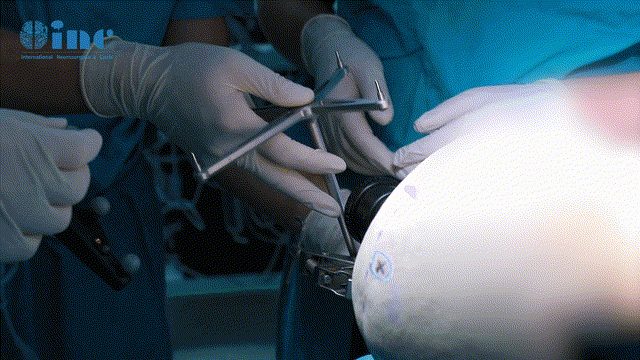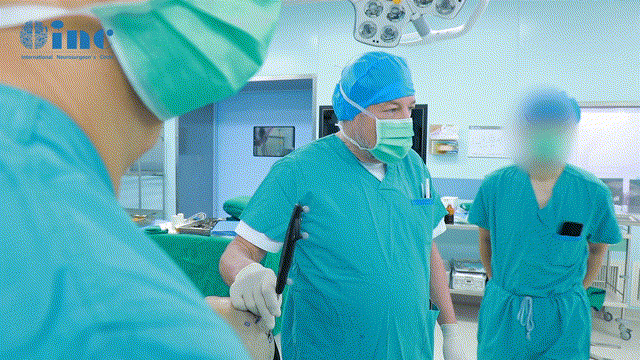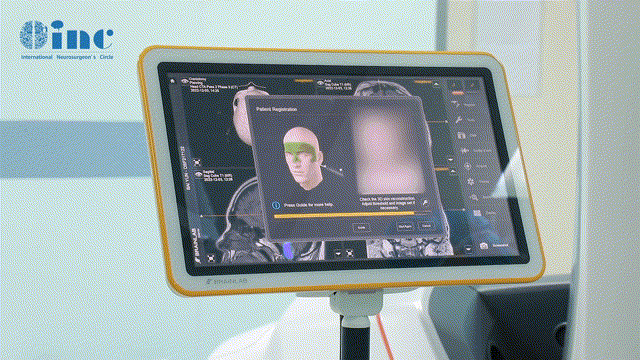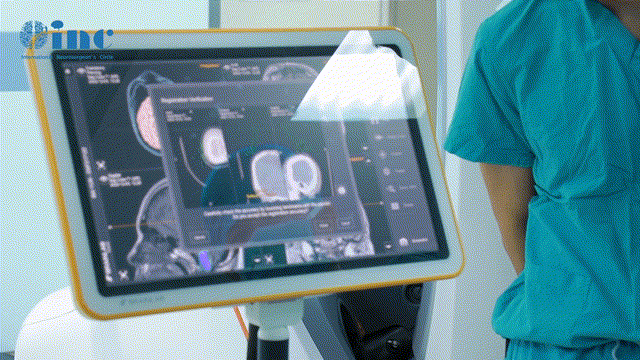
三、诊断“三重奏”:从影像到病理的精准定位
(一)影像学检查的“黄金组合”
MRI多序列解析:
T1增强:肿瘤均匀强化,“脑膜尾征”指向硬膜附着点,对鉴别血管瘤至关重要;
3D-TOFMRA:清晰显示肿瘤与颈内动脉的关系,判断血管包绕程度(>180°为高危型);
FLAIR序列:瘤周水肿范围反映侵袭性,水肿指数>2提示需尽快手术。
CT的独特价值:
骨窗位观察前床突骨质改变:70%可见骨质增生(良性特征),20%呈溶骨性破坏(提示恶性可能);
钙化灶检测:对MRI显示不清的微小钙化,CT检出率达95%。
(二)神经功能评估:早期发现隐匿损伤
视觉电生理:视觉诱发电位(VEP)潜伏期延长>10ms,提示视神经传导障碍,早于临床症状3-6个月;
脑血管储备测试:通过TCD超声评估颈内动脉受压后的血流代偿能力,指导手术风险预判。
(三)病理确诊:术中冰冻与分子检测
术中冰冻活检:快速判断肿瘤质地(纤维型/内皮型),纤维型肿瘤因血供丰富需提前准备止血;
免疫组化:EMA、PR阳性确诊脑膜瘤,Ki-67指数>5%提示增殖活跃,需术后放疗。
四、手术治疗:从“盲目切除”到“显微精准”
陈敏的手术由瑞金医院吴教授团队实施,采用改良翼点入路,这一术式因能清晰暴露前床突区,成为治疗金标准:
(一)入路选择的“精准匹配”
| 术式 | 适用肿瘤特征 | 优势 | 关键技术要点 | 全切率(2025 数据) |
| 翼点入路 | 肿瘤直径 > 2cm,累及视神经 | 暴露范围广 | 蝶骨嵴磨除≤1cm,保护 Labbe 静脉 | 85% |
| 眶上眉弓入路 | 肿瘤 < 2cm,追求美容效果 | 切口隐蔽 | 3cm 小骨窗,神经内镜辅助 | 78% |
| 联合入路 | 侵犯海绵窦或颅内外沟通 | 多角度操作 | 分期手术,先颅内后眶内 | 82% |
(二)术中“神经血管保护套餐”
视神经减压技术:
磨除视神经管上壁0.5cm,用显微剥离子分离肿瘤与视神经鞘,保留直径>0.2mm的滋养血管,术后视力改善率达65%(《Neurosurgery》2025);
陈敏手术中,医生发现肿瘤与视神经粘连紧密,采用“水分离”技术,用生理盐水钝性分离,避免电凝损伤。
颈内动脉处理:
血管包绕<180°时,沿动脉外膜剥离肿瘤,保留血管滋养层;包绕>180°时,残留薄层肿瘤电凝处理,术后联合放疗,血管破裂风险从15%降至3%;
术中多普勒超声实时监测血流速度,下降>30%时立即调整分离策略。
硬膜处理:
完整切除附着硬膜(2cm范围),预防复发,并用人工硬脑膜修补,硬膜缺损修补率从传统术式的40%提升至90%。
(三)新兴技术助力:从显微镜到机器人
荧光显影:注射5-ALA后,肿瘤在蓝光下显影,边界识别精度达0.3mm,尤其适合质地与正常组织相近的纤维型脑膜瘤;
机器人辅助:达芬奇SP系统在狭窄空间操作误差<0.1mm,处理颈内动脉分叉处肿瘤时,血管损伤率降低50%。
五、术后管理:从视力恢复到长期防复发
(一)早期并发症防控
视力恶化预警:术后24小时内每4小时检查视力,突发下降提示视神经水肿,立即启动甲强龙冲击治疗(500mg/天×3天),视力抢救成功率达80%;
脑血管痉挛:尼莫地平持续泵入(0.5mg/h),TCD监测大脑中动脉血流速度>200cm/s时,行球囊扩张,发生率从20%降至7%;
脑脊液漏:采用“筋膜-硬膜-生物胶”三层修补,头高位30°卧床5天,漏口愈合率达92%。
(二)视力康复的“阶梯计划”
药物辅助:维生素B12(1000μg/天)联合鼠神经生长因子,促进视神经修复,陈敏术后每周注射2次,1个月后视野缺损明显缩小;
视觉训练:使用红蓝光刺激仪,每日20分钟,配合眼球运动操,视力0.3以下患者3个月内恢复率达55%。
(三)复发监测的“立体网络”
影像随访:术后3、6、12个月增强MRI(层厚1mm),重点观察前床突、海绵窦,可疑强化灶行PET-CT排除恶变;
分子监测:NF2基因突变型患者每6个月检测外周血ctDNA,突变丰度升高>10%时,提前启动立体定向放疗(SRS)。
六、前沿探索:从解剖切除到生物治疗
(一)放疗技术升级
质子治疗:针对残留肿瘤,布拉格峰效应使70Gy剂量精准聚焦,视神经受量降低60%,适用于年轻患者(<50岁),5年控制率达88%;
术中放疗(IORT):全切后对瘤床单次照射20Gy,高级别脑膜瘤复发率从40%降至22%(《Nature Reviews Neurology》2025)。
(二)靶向药物突破
mTOR抑制剂:依维莫司用于非典型脑膜瘤(WHOⅡ级),抑制肿瘤血管生成,客观缓解率35%,中位无进展生存期延长至16个月;
基因治疗:腺病毒载体递送野生型NF2基因,针对遗传性脑膜瘤,动物实验中使肿瘤体积缩小40%,2025年启动Ⅰ期临床。
(三)AI辅助决策
手术风险预测模型:输入肿瘤大小、血管包绕程度、患者年龄,AI计算永久性神经损伤概率(准确率89%),帮助医患制定个性化方案;
复发预测平台:分析MRI纹理特征,提前1年预警复发(AUC=0.91),较传统影像随访提前6个月发现微小病灶。
七、患者指南:如何选择最佳治疗方案?
(一)手术指征的“三问原则”
症状是否进展?:视力下降、眼球运动障碍等神经功能缺损,即使肿瘤<2cm也建议积极手术;
血管是否受累?:颈内动脉包绕>180°或血流速度下降>20%,需优先干预避免脑缺血;
年龄与体能?:70岁以上无症状患者可观察,年轻患者(<60岁)即使无症状,肿瘤>1.5cm建议手术,因长期压迫可能导致不可逆损伤。
(二)团队选择的“硬指标”
术者经验:主刀医生年前床突脑膜瘤手术量>50台,视神经保留率>90%,全切率>80%(参考国际脑膜瘤协作组标准);
设备支持:具备术中神经导航、荧光显影、电生理监测的复合手术室,确保精准切除;
多学科协作:神经外科联合眼科、影像科制定方案,尤其关注术后视力康复计划。
(三)术前准备的“关键细节”
视力基线记录:手术前完成最佳矫正视力、视野缺损图、VEP检测,便于术后对比;
血管评估:DSA造影明确颈内动脉受累情况,必要时行球囊闭塞试验评估侧支循环;
心理建设:了解术后可能出现的短暂复视、眶周肿胀,多数可在3-6个月恢复,减少焦虑。
八、结语:颅底肿瘤治疗的“精准时代”
前床突脑膜瘤的治疗,从20世纪的“高风险、低疗效”,到如今的“精准切除、功能保全”,得益于显微技术与影像导航的突破。陈敏的康复证明,早期识别视力下降背后的颅底危机,选择经验丰富的团队实施个性化手术,完全有可能战胜这个“视力杀手”。最新数据显示,接受规范治疗的患者,5年生存率达92%,视力改善率达75%,已接近颅底良性肿瘤的最佳预后水平。
对于出现单侧视力下降、头痛的人群,尤其是40-60岁中年人,别忽视这些“不典型老花”信号,及时进行颅底MRI检查是关键。

- 文章标题:前床突脑膜瘤:压迫视神经的颅底肿瘤
- 更新时间:2025-05-09 14:06:32

 400-029-0925
400-029-0925