当体检报告或诊断书中出现"大脑基底节内囊病变"时,多数人会感到陌生与担忧。这一术语究竟指向何种脑部异常?简单来说,基底节与内囊是大脑深部的重要结构组合——基底节由多个核团构成,负责调控运动、认知与情绪;内囊则是连接大脑皮层与脊髓的"神经信息高速公路",聚集着大量神经纤维束。所谓"病变",泛指这些区域因各种原因出现的结构或功能异常,可能引发运动障碍、感觉异常甚至意识障碍等一系列症状。这类病变的复杂性在于其解剖位置深在、神经纤维密集,一旦受损可能影响全身多个系统功能。接下来,我们将从解剖基础、致病原因、典型症状、诊断方法、治疗策略到康复管理进行全面解析,帮助读者系统理解这一脑部病变的全貌。

解剖学基础:基底节与内囊的精密构造
(一)基底节:大脑的运动调控中枢
基底节并非单一结构,而是由尾状核、豆状核(含壳核与苍白球)、屏状核及杏仁核等组成的核团复合体。这些核团通过复杂的神经环路与大脑皮层、丘脑、脑干等区域相连,形成"皮层-基底节-丘脑-皮层"的闭环系统。其核心功能在于调节运动的协调性、控制肌肉张力,并参与学习记忆、情绪调控等高级神经活动。以苍白球为例,它通过抑制性神经递质γ-氨基丁酸(GABA)对丘脑的运动信号进行筛选,避免多余动作的产生;而尾状核则与多巴胺能神经通路密切相关,这也是帕金森病患者出现震颤症状的解剖学基础。
(二)内囊:神经信号的交通枢纽
内囊呈"V"字形,位于尾状核、豆状核与丘脑之间,看似狭小的区域却承载着大脑80%以上的上下行神经纤维。其解剖学分区极具临床意义:前肢连接额叶与丘脑,后肢包含皮质脊髓束(支配肢体运动)、皮质丘脑束(传导感觉)及视辐射(视觉传导)等重要纤维束,膝部则走行着支配面部肌肉的皮质脑干束。这种高度密集的纤维排列使得内囊成为易受损伤的"薄弱地带",哪怕微小的病变都可能导致严重的功能障碍——例如后肢受损常引起对侧肢体偏瘫,而膝部病变则可能导致面瘫与舌肌麻痹。
(三)血液供应:脆弱的血管网络
基底节与内囊的血供主要来自大脑中动脉的深穿支——豆纹动脉,因其形似"豆荚"且供应纹状体而得名。这些血管从大脑中动脉呈直角分出,管径纤细(直径约0.2-0.5mm),管壁缺乏弹力纤维,在长期高血压等因素作用下极易发生玻璃样变性。临床数据显示,约60%的高血压性脑出血发生在基底节区,正是由于豆纹动脉破裂所致。此外,内囊后肢还接受来自大脑后动脉的脉络膜后动脉供血,这种多源供血特性虽提供了一定代偿可能,但也使得血管病变的影响更为复杂。
致病因素:多维度解析病变根源
(一)血管性病变:最常见的致病类型
1.缺血性卒中
约70%的基底节内囊病变由脑梗死引起,其中大脑中动脉深穿支闭塞占比达85%。当豆纹动脉因动脉粥样硬化斑块或心源性栓子阻塞时,局部脑组织因缺血缺氧发生坏死,典型如"内囊后肢梗死"可导致对侧偏瘫、偏身感觉障碍与偏盲(即"三偏综合征")。一项发表于《Neurology》的研究指出,在所有缺血性卒中患者中,基底节区受累者占32.7%,且致残率较皮层梗死高出1.8倍。
2.出血性卒中
高血压是基底节出血的首要危险因素,长期血压升高可使豆纹动脉形成微小动脉瘤(Charcot-Bouchard动脉瘤),在情绪激动或用力时破裂。临床数据显示,基底节区出血占自发性脑出血的60%-70%,出血量超过30ml者死亡率可达40%。值得注意的是,非高血压性出血可见于脑淀粉样血管病(好发于老年人)、动静脉畸形(青少年多见)等病因,需通过影像学检查鉴别。
(二)肿瘤性病变:从良性到恶性的谱系
1.原发性脑肿瘤
基底节内囊区的原发性肿瘤以胶质瘤最为常见,其中低级别星形细胞瘤(WHOⅡ级)占45%,多呈浸润性生长,早期可无明显症状;而胶质母细胞瘤(WHOⅣ级)虽发病率较低(约15%),但进展迅速,常伴出血坏死,患者多以突发偏瘫或癫痫起病。少突胶质细胞瘤则约占10%,因富含血管而易被误诊为血管畸形。
2.转移性肿瘤
肺癌、乳腺癌等实体瘤经血行转移至基底节区的比例约为脑转移瘤的12%,由于内囊血供丰富,转移灶常压迫神经纤维束,出现"症状重、体征典型"的特点。一项来自MD安德森癌症中心的回顾性研究显示,基底节转移瘤患者的中位生存期为6.8个月,显著低于皮层转移患者的9.2个月。
(三)感染与炎症性疾病
1.颅内感染
化脓性脑膜炎或脑脓肿可蔓延至基底节区,葡萄球菌、链球菌是最常见致病菌。结核性脑膜炎时,脑底池的结核性渗出物可压迫内囊血管,导致缺血性病变。数据显示,在结核性脑膜炎患者中,约23%会出现基底节区异常信号。
2.自身免疫性脑病
抗N-甲基-D-天冬氨酸(NMDA)受体脑炎等自身免疫性疾病可累及基底节,患者除精神症状外,常伴口面部不自主运动。一项发表于《Brain》的研究指出,此类患者中38%存在基底节受累,且对免疫治疗反应差异较大。
(四)代谢与退行性疾病
1.代谢性脑病
肝性脑病时,血氨升高可导致基底节区对称性异常信号,尤以苍白球受累明显;糖尿病酮症酸中毒患者中,约15%会出现基底节区缺血性改变。而戊二酸血症Ⅰ型等遗传代谢病,则因有机酸蓄积造成基底节神经元损伤,患儿多在婴幼儿期发病,表现为进行性运动障碍。
2.退行性病变
帕金森病的病理基础是黑质-纹状体多巴胺能神经元变性,影像学可见壳核多巴胺转运体减少;亨廷顿病则以尾状核萎缩为特征,患者出现舞蹈样动作与认知衰退。据《Movement Disorders》杂志统计,基底节退行性病变占中老年运动障碍疾病的65%以上。
(五)其他少见病因
-外伤:头部钝挫伤可导致内囊区弥漫性轴索损伤,约12%的重型颅脑损伤患者会出现基底节出血;
-医源性因素:脑室穿刺或深部脑刺激术(DBS)操作中可能误伤内囊纤维,虽发生率低于0.5%,但需严格规避;
-先天性异常:如脑穿通畸形囊肿,可因胚胎发育异常导致基底节结构缺损。
典型症状:从局部到全身的功能异常
(一)运动功能障碍:最突出的临床表现
1.偏瘫与肌力减退
内囊后肢的皮质脊髓束受损时,对侧肢体出现中枢性瘫痪,表现为肌张力增高、腱反射亢进及病理征阳性(如巴宾斯基征)。临床观察显示,内囊病变所致偏瘫具有"上下肢受累程度相当"的特点,与皮层病变引起的单肢瘫不同。当病灶累及基底节时,除偏瘫外还可伴发不自主运动,如壳核损伤导致的偏身舞蹈症。
2.肌张力异常与共济失调
苍白球或丘脑底核病变可引起肌张力增高,表现为铅管样或齿轮样强直,常见于帕金森综合征;而尾状核受损则可能出现肌张力减低,如亨廷顿病的舞蹈样动作。值得注意的是,基底节病变所致共济失调与小脑病变不同,其特点是"动作起始困难"而非"意向性震颤"。
(二)感觉与视觉障碍:多维度神经功能缺损
1.偏身感觉障碍
内囊后肢的丘脑皮质束受损时,对侧躯体出现深浅感觉均减退,且以远端更为明显。这种感觉异常常与运动障碍并存,形成"运动-感觉联合障碍",严重影响患者日常生活能力。一项针对120例内囊病变患者的研究显示,89%存在不同程度的感觉缺失,其中43%伴有疼痛过敏。
2.视野缺损与视觉传导异常
内囊后肢的视辐射受损可导致对侧同向性偏盲,即双眼视野的同一侧缺失。与皮层性偏盲不同,内囊病变所致偏盲多无黄斑回避现象(中心视野保留)。当基底节区肿瘤压迫视束时,还可能出现瞳孔对光反射异常。
(三)认知与情绪障碍:被忽视的深层影响
1.认知功能下降
基底节与前额叶皮层的环路连接受损时,患者可出现执行功能障碍(如计划、决策能力下降)、记忆力减退及语言流畅性降低。研究表明,基底节区梗死患者中,约35%在1年内发展为血管性痴呆,显著高于皮层梗死的22%。
2.情绪与行为异常
尾状核与边缘系统的联系中断可导致抑郁、焦虑等情绪障碍,临床观察显示,基底节病变患者的抑郁发生率达41%,且常与运动障碍程度不平行。部分患者还会出现强迫行为或冲动控制障碍,如病理性赌博,这可能与多巴胺系统失衡有关。
(四)其他系统症状:全身功能的连锁反应
1.言语与吞咽障碍
内囊膝部的皮质脑干束受损可导致构音障碍与吞咽困难,患者表现为说话含糊不清、饮水呛咳,严重者需留置胃管。据统计,此类患者中误吸性肺炎的发生率较普通卒中患者高2.3倍。
2.自主神经功能紊乱
基底节区的下丘脑投射纤维受累时,可出现血压波动、心率不齐及体温调节异常。在丘脑出血患者中,约25%会出现神经源性肺水肿,这与交感神经过度激活密切相关。
(五)不同病变类型的症状特征
| 病变类型 | 典型症状组合 | 起病特点 | 症状进展速度 |
| 基底节出血 | 突发偏瘫+头痛+意识障碍 | 数分钟达高峰 | 凶险,24小时内变化显著 |
| 内囊梗死 | 偏瘫+偏身感觉障碍+偏盲 | 数小时渐进加重 | 1-3天稳定 |
| 低级别胶质瘤 | 缓慢进展的偏瘫+癫痫 | 隐匿起病 | 数月至数年 |
| 转移性肿瘤 | 急性偏瘫+颅内压增高症状 | 亚急性起病 | 2-4周恶化 |
| 帕金森病 | 震颤+肌强直+运动迟缓 | 隐匿起病 | 逐年加重 |
诊断流程:从临床评估到精准影像
(一)病史采集与体格检查:诊断的第一步
1.关键病史要素
-起病形式:突然起病(如卒中)或渐进发展(如肿瘤);
-危险因素:高血压、糖尿病、心房颤动等血管病危险因素;
-伴随症状:头痛、呕吐提示颅内压增高,发热提示感染可能;
-家族史:亨廷顿病等遗传性疾病需明确家族史。
2.神经系统查体重点
-运动功能:肌力分级(采用Lovett六级法)、肌张力测定;
-感觉检查:痛温觉、本体感觉及皮层觉评估;
-特殊体征:巴宾斯基征、查多克征等病理反射;
-共济运动:指鼻试验、跟膝胫试验。
(二)影像学检查:定位定性的核心手段
1.CT检查:急诊首选的快速评估
-优势:对脑出血敏感性高,可在10分钟内完成检查;
-表现:基底节区出血呈高密度影,梗死24小时后可见低密度灶;
-局限:对早期梗死(<6小时)及小病灶(<5mm)显示不佳。
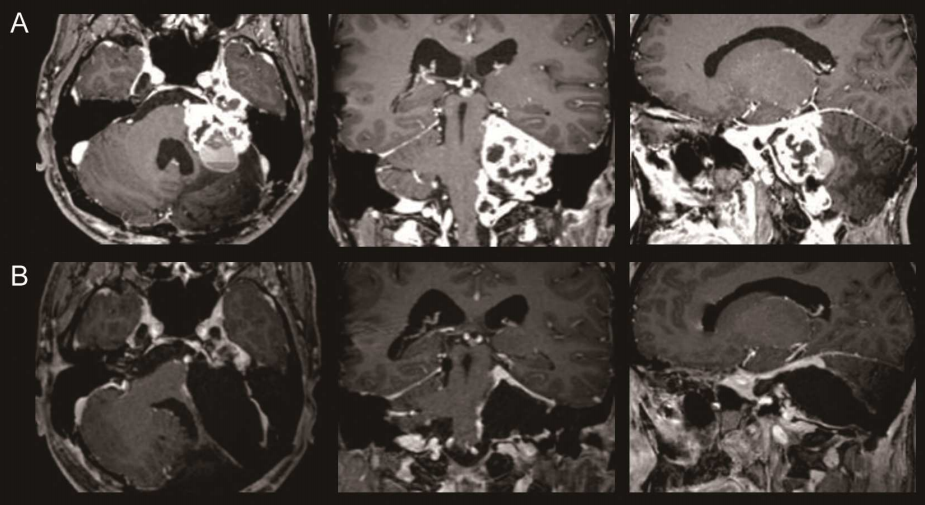
2.MRI检查:精准诊断的金标准
-T1WI:显示解剖结构,出血急性期呈等信号,亚急性期呈高信号;
-T2WI:对水肿敏感,梗死灶呈高信号,肿瘤常伴周围水肿带;
-DWI(弥散加权成像):超早期梗死(<3小时)呈明显高信号,ADC值降低;
-SWI(磁敏感加权成像):对微出血灶检出率高于CT,有助于鉴别血管畸形。
3.脑血管成像:评估血供与病变性质
-CTA(CT血管成像):快速显示颅内大血管狭窄或动脉瘤;
-MRA(磁共振血管成像):无辐射,适用于筛查脑动脉粥样硬化;
-DSA(数字减影血管造影):有创检查,是诊断动静脉畸形的"金标准",但仅在必要时使用。
(三)实验室与特殊检查:病因鉴别辅助手段
1.血液检查
-常规项目:血常规、凝血功能、血糖、血脂;
-特殊项目:肝肾功能(排除代谢性脑病)、自身抗体(筛查免疫性疾病)、血氨(肝性脑病)。
2.脑脊液检查
-适应症:怀疑感染、自身免疫性疾病或肿瘤脑膜转移;
-检查内容:压力、细胞数、蛋白含量、糖氯水平及病原学检测。
3.电生理检查
-脑电图(EEG):对基底节区癫痫样放电的检出率约为65%;
-肌电图(EMG):鉴别神经源性与肌源性损害,适用于慢性病变。
(四)鉴别诊断:避免误诊的关键环节
1.卒中与肿瘤的鉴别
| 鉴别点 | 缺血性卒中 | 脑肿瘤 |
| 起病方式 | 急性(分钟-小时) | 亚急性(周-月) |
| 头痛 | 少见(除大面积梗死) | 常见(进行性加重) |
| 影像学特征 | 血管分布区异常 | 占位效应+强化 |
| 进展模式 | 2-3天稳定 | 持续进展 |
2.退行性与血管性病变的鉴别
-帕金森病:震颤以静止性为主,对左旋多巴反应良好;
-血管性帕金森综合征:多有卒中病史,步态障碍更突出,左旋多巴疗效差。
(五)量化评估:功能预后的预测工具
1.神经功能缺损评分
-NIHSS评分(美国国立卫生研究院卒中量表):评估卒中严重程度,范围0-42分;
-mRS评分(改良Rankin量表):评价残疾程度,0-6分,≥3分提示需他人照料。
2.认知功能评估
-MMSE(简易智力状态检查):筛查认知障碍,总分30分,<24分提示痴呆;
-MoCA(蒙特利尔认知评估):对血管性认知障碍更敏感,总分30分,<26分异常。
治疗策略:多学科协作的个体化方案
(一)急性期治疗:挽救神经功能的黄金期
1.缺血性病变的再灌注治疗
-静脉溶栓:发病4.5小时内,符合指征者给予阿替普酶(0.9mg/kg),基底节区梗死的血管再通率约为68%;
-血管内治疗:大血管闭塞(如大脑中动脉M1段)者,发病6-24小时内可进行机械取栓,基底节区梗死的良好预后率较单纯药物治疗提高2.3倍。
2.出血性病变的急诊处理
-血压管理:收缩压>220mmHg时,持续静脉输注降压药使血压维持在140/90mmHg以下;
-手术指征:基底节出血量>30ml且意识障碍加重,或出现脑疝征象时,需行开颅血肿清除术或微创穿刺引流术。一项多中心研究显示,发病72小时内手术可使死亡率降低19%。
(二)药物治疗:贯穿全程的基础干预
1.神经保护与对症治疗
-脑保护剂:依达拉奉清除自由基,尤适用于急性梗死;
-抗癫痫药物:基底节区病灶伴癫痫发作者,首选左乙拉西坦;
-改善认知:血管性痴呆患者可使用多奈哌齐,每日5-10mg。
2.病因针对性治疗
-动脉粥样硬化:阿司匹林(100mg/d)+他汀类药物(如阿托伐他汀20mg/d);
-自身免疫性脑病:甲泼尼龙冲击治疗(1g/d,连续3天)+免疫球蛋白(0.4g/kg/d,连续5天);
-帕金森病:左旋多巴起始剂量125mg,每日3次,根据症状调整剂量。
(三)手术治疗:精准干预的关键手段
1.肿瘤切除术
-适应症:基底节区良性肿瘤(如脑膜瘤)或局限的低级别胶质瘤;
-手术入路:经侧脑室三角区或脑沟入路,避免直接损伤内囊纤维;
-技术要点:术中神经导航+电生理监测,保护运动/感觉传导束,全切率可达75%(低级别胶质瘤)。
2.功能性手术
-深部脑刺激术(DBS):适用于药物难治性帕金森病,刺激靶点为苍白球内侧部(GPi)或丘脑底核(STN),可使症状改善50%-60%;
-立体定向毁损术:因并发症较多,目前仅用于无法耐受DBS的患者。
(四)康复治疗:功能重建的核心环节
1.运动功能康复
-早期床上活动:发病48小时后开始被动关节活动,预防肌肉萎缩;
-恢复期训练:借助减重步态训练仪、机器人辅助装置等,改善步行能力;
-作业治疗:针对手功能障碍,采用任务导向性训练,每日2次,每次30分钟。
2.认知与语言康复
-认知训练:通过记忆游戏、问题解决训练等,改善执行功能;
-言语治疗:针对构音障碍,使用发音训练器进行唇舌肌训练;吞咽障碍者采用门德尔松手法,配合糊状饮食。
3.传统康复手段
-针灸:选取曲池、合谷、足三里等穴位,促进神经功能恢复;
-理疗:经颅磁刺激(TMS)可改善运动功能,每周5次,连续4周为1疗程。
(五)多学科协作模式
| 学科 | 角色与职责 | 干预时机 |
| 神经科 | 病因诊断、药物治疗方案制定 | 全程参与 |
| 神经外科 | 评估手术指征、实施手术干预 | 符合手术条件时 |
| 康复科 | 制定康复计划、指导功能训练 | 病情稳定后48-72小时 |
| 影像科 | 提供精准影像学诊断 | 诊断与随访阶段 |
| 心理科 | 评估情绪障碍、实施心理干预 | 发现心理问题时 |
| 营养科 | 制定个性化饮食方案、预防营养不良 | 急性期至恢复期 |
(六)新兴治疗技术展望
1.干细胞治疗
间充质干细胞移植可改善基底节区梗死的神经功能,一项Ⅱ期临床试验显示,移植后6个月mRS评分较对照组降低1.2分。
2.基因治疗
针对亨廷顿病的反义寡核苷酸(ASO)疗法已进入Ⅲ期试验,可减少突变huntingtin蛋白的表达,延缓疾病进展。
3.脑机接口
对于严重偏瘫患者,脑机接口设备可通过意念控制外骨骼机器人,初步研究显示可使动作完成率提高35%。
预后与管理:长期健康的保障策略
(一)预后影响因素分析
1.病变性质与范围
-缺血性卒中:内囊后肢小灶梗死(<1cm)者,90天良好预后率(mRS 0-2分)达78%,而大面积基底节出血者死亡率超过50%;
-肿瘤:低级别胶质瘤全切后5年生存率为85%,胶质母细胞瘤中位生存期仅14.6个月。
2.治疗时机与方式
-缺血性卒中:发病3小时内溶栓,血管再通率达81%,较6小时后溶栓高出3倍;
-手术治疗:基底节血肿发病24小时内清除,可使致残率降低29%。
3.患者整体状况
-年龄>75岁、合并糖尿病或心脏病者,预后较差;
-积极参与康复训练者,功能恢复速度较被动接受治疗者快1.5倍。
(二)长期管理要点
1.基础疾病管理
-高血压:血压控制在<130/80mmHg,首选ACEI或ARB类药物;
-糖尿病:糖化血红蛋白(HbA1c)控制在7.0%以下,避免低血糖发生;
-血脂异常:低密度脂蛋白胆固醇(LDL-C)降至<1.8mmol/L,首选他汀类药物。
2.并发症预防
-深静脉血栓:卧床患者常规使用弹力袜+低分子肝素抗凝,直至完全离床;
-压疮:每2小时翻身一次,使用减压床垫,已发生压疮者可用水胶体敷料;
-肺部感染:吞咽障碍者抬高床头30°,定期进行胸部物理治疗。
3.生活方式调整
-饮食:低盐低脂饮食,每日钠盐摄入<5g,增加蔬菜水果摄入;
-运动:病情稳定后尽早开始有氧运动,如散步、游泳,每周5次,每次30分钟;
-戒烟限酒:吸烟使卒中复发风险增加2-4倍,酒精摄入男性每日不超过25g,女性不超过15g。
(三)随访计划与监测指标
| 随访时间点 | 重点检查项目 | 目的 |
| 出院后1个月 | 头颅CT/MRI+NIHSS评分 | 评估病变吸收情况与神经功能 |
| 出院后3个月 | 血常规+肝肾功能+血脂 | 监测药物不良反应与基础疾病 |
| 出院后6个月 | 头颅MRI+MRA+认知评估 | 筛查复发风险与认知障碍 |
| 每年1次 | 全身体检+脑血管超声 | 整体健康状况评估 |
(四)心理社会支持
1.患者心理干预
-认知行为疗法(CBT):针对抑郁情绪,每周1次,持续8-12周;
-正念减压训练:每日15-20分钟,可降低焦虑水平25%。
2.家庭支持系统构建
-照护者培训:学习正确的翻身、喂食技巧,掌握癫痫发作时的应急处理;
-社会资源链接:协助申请残疾证、联系社区康复机构,减轻家庭负担。
3.回归社会准备
-职业康复:根据残留功能,进行工作能力评估与适应性训练;
-社交活动参与:鼓励加入患者互助小组,分享经验,减少孤独感。
常见问题答疑
1.大脑基底节内囊病变一定会导致偏瘫吗?
不一定。病变的部位与范围决定症状严重程度:若内囊后肢的皮质脊髓束完全受损,会出现典型偏瘫;但小灶性病变(如腔隙性梗死)可能仅表现为轻度肌力减退或单纯感觉异常。临床数据显示,约65%的基底节内囊病变患者会出现不同程度的运动障碍,但早期干预可显著改善预后。
2.基底节出血后还能恢复正常生活吗?
取决于出血量与治疗时机。出血量<10ml且未累及关键结构者,经积极康复后约70%可恢复生活自理;出血量>30ml者预后较差,但仍有30%的患者在1年内通过系统康复实现部分功能重建。需要强调的是,发病6个月内是功能恢复的黄金期,应抓住时机进行强化训练。
3.如何预防基底节内囊区的血管性病变?
关键在于控制危险因素:高血压患者需将血压稳定在130/80mmHg以下,糖尿病患者糖化血红蛋白控制在7.0%以下,血脂异常者LDL-C降至1.8mmol/L以下。此外,戒烟、限酒、规律运动(每周150分钟中等强度运动)可使卒中风险降低40%以上。
4.基底节区肿瘤手术风险高吗?
由于邻近内囊等重要结构,手术风险相对较高。但在有经验的神经外科中心,采用术中神经导航+电生理监测技术,低级别胶质瘤的全切率可达75%以上,且严重并发症发生率<5%。术后是否出现功能障碍,与肿瘤是否侵犯神经纤维束密切相关,早期发现、早期手术是降低风险的关键。
5.帕金森病与基底节病变有什么关系?
帕金森病的病理基础是基底节区(尤其是黑质-纹状体通路)的多巴胺能神经元变性,导致多巴胺分泌减少。患者出现的震颤、肌强直等症状,本质上是基底节运动调控失衡的表现。因此,帕金森病属于基底节退行性病变的一种,其治疗也围绕恢复基底节区的神经递质平衡展开。
6.儿童会发生基底节内囊病变吗?
会,儿童基底节病变常见于代谢性疾病(如戊二酸血症)、遗传性脑病(如肝豆状核变性)及感染后炎症反应。与成人不同,儿童病变常以发育迟缓、肌张力异常为首发症状,而非典型偏瘫。若发现孩子出现不明原因的运动障碍或认知落后,应及时排查基底节区病变。
7.康复训练需要持续多久?
康复是一个长期过程,通常建议至少持续1年。研究显示,发病后6个月内功能恢复最快,1-2年内仍有进步空间。即使病程超过2年,坚持针对性训练仍可维持现有功能,防止并发症。建议根据康复评估结果制定个性化方案,定期调整训练强度与目标。
8.出现哪些症状需要立即就医?
突发的一侧肢体麻木无力、言语不清、视物重影或意识模糊,可能是基底节内囊区急性病变(如卒中)的表现,需立即拨打急救电话。此类疾病具有"时间就是大脑"的特点,发病4.5小时内的溶栓治疗可显著改善预后,延误治疗可能导致不可逆的神经损伤。
- 文章标题:大脑基底节内囊病变是什么意思?
- 更新时间:2025-05-28 15:52:26

 400-029-0925
400-029-0925