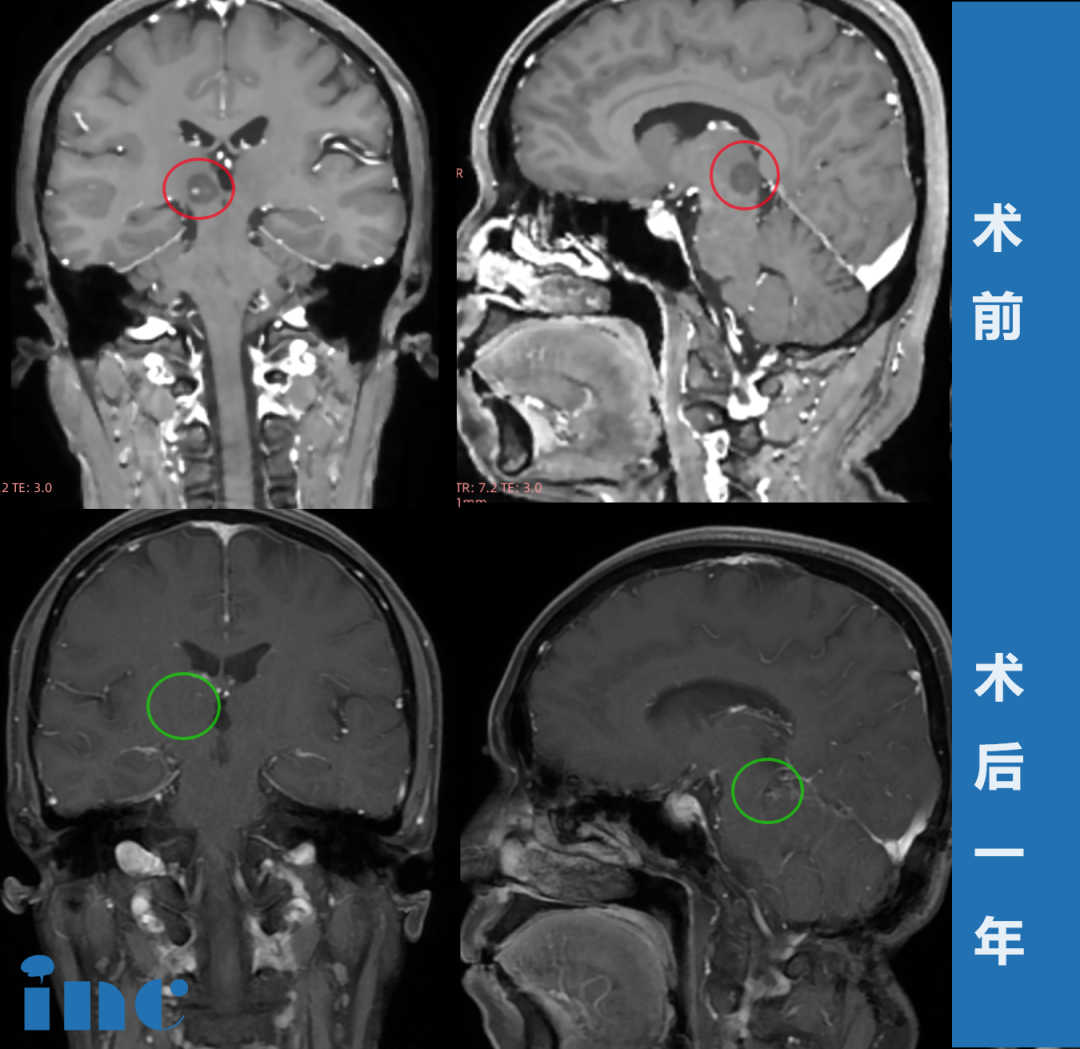
硬脑膜动静脉瘘分型详解:硬脑膜动静脉瘘的分型不仅是一个学术概念,更是直接决定着治疗决策和预后判断的临床路标。
硬脑膜动静脉瘘(DAVF)作为一种发生在硬脑膜上的异常动静脉交通疾病,占所有脑血管畸形的10%-15%。这种病变的本质是动脉血不经过正常的毛细血管床而直接流入静脉系统,导致一系列血流动力学改变。
分型系统的重要性在于它能有效预测疾病的自然病程和出血风险,从而指导临床治疗策略的选择。今天我们就来全面了解硬脑膜动静脉瘘的各种分型方法及其临床意义。
硬脑膜动静脉瘘的基本概念
硬脑膜动静脉瘘是什么?简单来说,它是脑膜动脉与硬脑膜静脉窦或蛛网膜下腔静脉之间的异常连接。这种病变并非先天性的血管团畸形,而是获得性的动静脉直接交通。
正常情况下,在硬脑膜内存在一些极细小的动静脉交通支,但它们通常处于关闭状态。当某些因素(如静脉窦血栓形成、创伤、炎症等)导致静脉压力增高时,这些交通支可能会开放,形成病理性瘘口。
流行病学数据显示,DAVF可发生于任何年龄,但以50-60岁的人群发病率较高,男性稍多于女性(男女比例约为2:1)。儿童DAVF较为罕见,但通常是高流量型,且多为多发性和侵袭性发展。
主要分型系统详解
Cognard分型
Cognard分型是目前临床上应用最广泛的分型系统之一,它主要依据静脉引流方式将DAVF分为五型。
Ⅰ型是引流到静脉窦且血流方向正常的DAVF。这种类型的血流动力学改变相对较轻,静脉窦仍然保持正常的顺行引流功能。
Ⅱ型则出现了反向血流,根据具体情况又分为三个亚型:Ⅱa型只有静脉窦的反向血流;Ⅱb型只有皮质静脉的反向血流;而Ⅱa+b型则同时存在静脉窦和皮质静脉的反向血流。
Ⅲ型是直接引流到皮质静脉,但不伴有皮质静脉的扩张。Ⅳ型同样是直接引流到皮质静脉,但伴有静脉扩张(直径大于5mm或是正常引流静脉的3倍以上)。
Ⅴ型是比较特殊的类型,其特征是向脊髓引流。这种类型的DAVF可能表现出脊髓症状而非脑部症状。
Borden分型
Borden分型是另一个经典的分型方法,它更加简洁实用,同样基于静脉引流特点将DAVF分为三型。
Ⅰ型是指血液直接引流入硬脑膜静脉窦或脑膜静脉,没有皮质静脉反流。这种类型的自然病史较为良性,年出血风险较低。
Ⅱ型是指血液既向静脉窦回流,也反向回流至软脑膜静脉。这种情况下的出血风险明显增加,因为皮质静脉承受了过高的动脉压力。
Ⅲ型是只向软脑膜静脉引流,不经过静脉窦。这是最具危险性的一型,因为高速的动脉血直接冲击皮质静脉,极易导致静脉破裂出血。
此外,Borden分型还对每型进一步分为a、b两个亚型,a型代表单发动静脉瘘,b型代表多发动静脉瘘。
Djindjian分型
在DAVF分型的历史发展中,Djindjian分型是较早提出的分类系统,为后续分型奠定了基础。
Ⅰ型是静脉直接引流到硬脑膜静脉窦或硬脑膜静脉。患者症状相对较轻,可能仅表现为搏动性耳鸣或轻度头痛。
Ⅱ型是引流到硬脑膜静脉窦的同时,伴有皮质静脉的逆行充盈。这种情况可能导致颅内压增高和更明显的神经系统症状。
Ⅲ型是直接引流到蛛网膜下腔或皮质静脉,不经过静脉窦。这类病变容易引起蛛网膜下腔出血,病情较为严重。
Ⅳ型是伴有硬脑膜或硬脑膜下静脉湖的形成,血液直接引流到这些静脉湖中。该型常引起明显的占位效应,病情最为严重。
分型的临床意义与重要性
分型与出血风险密切相关。研究表明,低级别DAVF(如BordenⅠ型或CognardⅠ/Ⅱa型)的年出血风险仅为0%-1.5%,而高级别DAVF(如BordenⅡ/Ⅲ型或CognardⅡb及以上)的年出血风险可高达8%-35%。
治疗决策的依据也主要基于分型结果。低级别DAFE可以选择保守治疗或随访观察,而高级别DAVF通常需要积极干预,以防止致命性出血或不可逆的神经功能损伤。
预后判断的价值不容忽视。不同分型的DAVF自然病史差异显著,低分型患者往往预后良好,而高分型患者即使经过积极治疗,仍可能残留不同程度的神经功能障碍。
不同部位DAVF的分型特点
海绵窦区DAVF较为特殊,常表现为眼动脉供血为主,患者多有眼部症状如突眼、结膜充血和视力下降。针对这一部位,还有专门的Barrow分型,根据供血动脉来源分为A、B、C、D四型。
颅前窝和颅中窝DAVF多引流到上矢状窦或蝶窦,临床表现以头痛、颅内出血和肢体功能障碍为主。这些部位的DAVF往往更容易出现皮质静脉引流,因此风险较高。
颅后窝DAVF主要涉及横窦-乙状窦区,患者常主诉杂音、耳鸣,也可出现感觉障碍和意识障碍。由于后颅窝空间有限,且包含脑干等重要结构,即使较小的出血也可能导致严重后果。
辅助检查与分型确定
DSA(数字减影血管造影)是诊断和分型的“金标准”。它可以清晰显示供血动脉、瘘口位置和静脉引流模式,为分型提供决定性依据。进行DSA检查时,通常需要完成六根血管的全面评估:双侧颈内动脉、颈外动脉和椎动脉。
CT和MRI是重要的无创筛查工具。特别是新兴的4D-CTA和CE TR-MRA技术,能够提供血流动力学的动态信息,对分型有较高的参考价值。这些无创检查尤其适用于筛查和随访。
超声检查在某些特定部位的DAVF(如横窦区)也有应用价值,可以显示特征性的“假内化”血流动力学模式。不过超声检查结果有一定主观性,需要经验丰富的操作者。
治疗策略与分型的关系
保守治疗的适应证主要是低级别DAVF(BordenⅠ型和CognardⅠ/Ⅱa型)。研究发现,部分低级别DAVF可能自行消退,而且干预治疗反而可能增加风险。一项荟萃分析显示,对BordenⅠ型DAVF进行干预会导致较高的死亡或永久性并发症风险。
血管内治疗是目前的主流方法,包括经动脉或静脉途径的栓塞术。对于高级别DAVF,这是首选治疗方法,可以有效阻断异常动静脉交通,降低出血风险。治疗路径和材料的选择需要根据瘘口的具体位置和分型特点个体化确定。
手术治疗主要适用于某些特定部位(如前颅窝)的DAVF,或者血管内治疗无法到达的病例。手术方式主要是切断静脉引流,消除瘘口。尽管血管内治疗发展迅速,手术仍然在某些复杂病例中发挥不可替代的作用。
放射治疗如立体定向放射手术,通常作为辅助治疗手段,尤其适用于手术或栓塞困难的情况。不过其效果需要较长时间才能显现,且完全闭塞率有限。
分型系统的新进展
随着对DAVF认识的深入,一些新的分型系统和评估工具也在不断发展。例如,Zipfel分型和VEBAS评分系统试图更精确地预测治疗结果和预后。
4D成像技术的进步使得无创分型评估成为可能。时间分辨成像技术可以显示血流的动态过程,为分型提供更多信息。这些新技术正在改变着DAVF的诊断和分型流程。
治疗策略的个性化是当前的发展趋势。基于分型、解剖位置、临床表现和患者整体状况的综合评估,制定最适合个体的治疗方案,是DAVF管理的未来方向。
常见问题解答
+硬脑膜动静脉瘘最常见的分型系统是哪种?
临床上最常用的是Cognard和Borden分型系统,两者均基于静脉引流方式划分。Cognard分型更为详细,分为五型;Borden分型更简洁,分为三型。医生会根据病情需要选择合适的分型方法。
+为什么高级别硬脑膜动静脉瘘更需要积极治疗?
因为高级别DAVF伴有皮质静脉反流,年出血风险高达8%-35%,可能造成严重神经功能损伤甚至死亡。积极治疗可有效阻断异常血流,降低出血风险。
+诊断硬脑膜动静脉瘘一定要做DSA吗?
DSA是诊断分型的金标准,尤其是治疗前必需。但CT、MRI等无创检查也可用于初步筛查和随访。新兴的4D-CTA等技术已能提供相当准确的血流动力学信息。
+硬脑膜动静脉瘘可以自行愈合吗?
低级别DAVF有自行消退的可能,研究显示约17.9%的患者可能自行改善。但高级别DAVF自愈可能性极低,需要医疗干预。
+不同分型的硬脑膜动静脉瘘预后差异大吗?
差异显著。低级别DAVF患者预后良好,高级别患者即使经过治疗,仍可能残留神经功能障碍。准确分型对预后判断至关重要。推荐阅读:硬脑膜动静脉瘘百科
- 文章标题:硬脑膜动静脉瘘分型有哪些?
- 更新时间:2025-10-28 14:07:24

 400-029-0925
400-029-0925