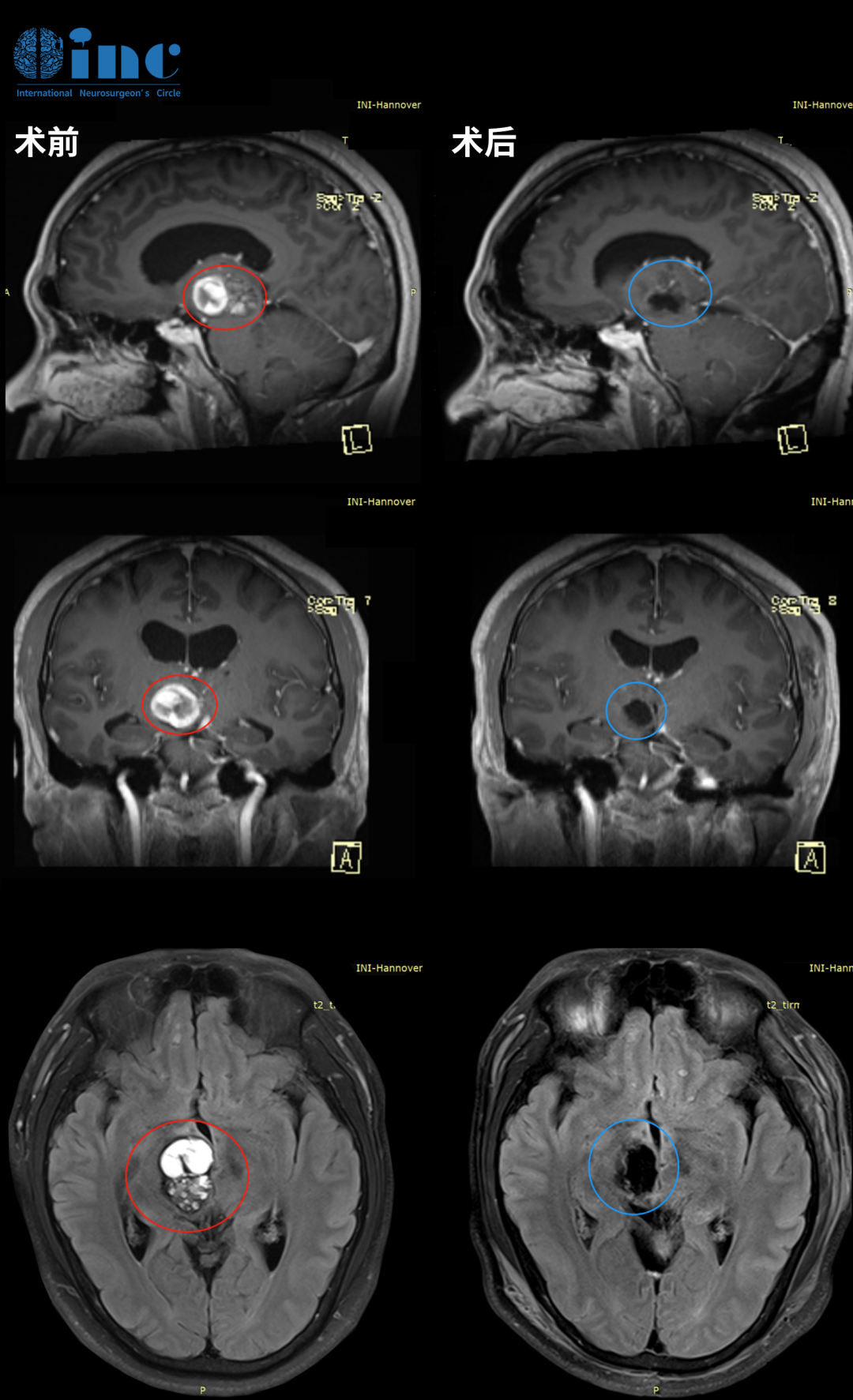
在中枢神经系统肿瘤的治疗版图中,髓母细胞瘤以其侵袭性生物学行为和儿童高发的特点,始终考验着临床医生的治疗智慧。作为综合治疗体系的核心支柱之一,化疗在控制微小残留病灶、延缓复发、改善高危患者预后等方面扮演着不可替代的角色。然而,面对种类繁多的化疗药物、个体化差异显著的治疗方案以及复杂的不良反应管理,患者和家属往往面临诸多困惑:哪些药物是治疗髓母细胞瘤的 "主力军"?不同危险分层的化疗方案如何制定?一次完整的化疗需要经历哪些阶段?又该如何应对治疗过程中的潜在风险?我们将从临床实践与循证医学角度出发,系统解析髓母细胞瘤化疗的关键问题,为精准治疗提供科学指引。

一、化疗在髓母细胞瘤治疗中的核心定位
髓母细胞瘤的化疗并非孤立存在,而是与手术、放疗构成 "三位一体" 的综合治疗体系。其核心价值体现在三个层面:新辅助化疗通过缩小原发肿瘤体积,提高手术全切除率,尤其适用于肿瘤与重要神经结构粘连紧密的病例;辅助化疗可杀灭术后残留的微小转移灶和放疗抵抗细胞,降低标准危险组患者的复发率,改善高危组患者的无进展生存期;挽救性化疗则在复发或难治性病例中发挥姑息治疗作用,为二次手术或靶向治疗争取时间窗口。根据国际儿童肿瘤协作组(如 COG、SIOP)的最新指南,化疗的介入时机与方案选择,需严格遵循肿瘤病理亚型(经典型、间变型 / 大细胞型)、分子分型(WNT 型、SHH 型、Group3、Group4)及危险分层(标准危险组、高危组)的精准匹配,形成真正意义上的个体化治疗策略。
二、髓母细胞瘤化疗药物分类与作用机制解析
髓母细胞瘤的化疗药物库涵盖四大类核心药物,其作用机制与临床应用各有侧重,需根据肿瘤生物学特性进行针对性选择(表 1)。
(一)烷化剂:DNA 链的 "分子胶水"
代表药物包括洛莫司汀(CCNU)、环磷酰胺(CTX)。此类药物通过与 DNA 碱基形成共价键,导致 DNA 链交联断裂,阻断细胞周期于 G2/M 期。洛莫司汀是脂溶性药物,可透过血脑屏障,在标准危险组常用的 CCV 方案(洛莫司汀 + 长春新碱 + 顺铂)中担当核心角色,其剂量为 110-130mg/m²,每 6 周口服一次。环磷酰胺则常用于大剂量化疗联合自体造血干细胞移植(HDC-ASCT),通过 1.5-2g/m² 的静脉冲击给药,破坏肿瘤细胞 DNA 复制。
(二)铂类药物:DNA 复制的 "分子剪刀"
顺铂(DDP)和卡铂(CBP)通过与 DNA 双链形成交叉联结,诱导细胞凋亡。顺铂在 CCV 方案中以 75mg/m² 静脉滴注(第 1 天),需配合充分水化以预防肾毒性;卡铂则常用于儿童患者,按 AUC5-6 计算剂量,其骨髓抑制毒性较顺铂温和,适用于骨髓储备功能较弱的患儿。铂类药物的抗癌活性与肿瘤细胞 DNA 修复能力密切相关,对 DNA 错配修复缺陷型肿瘤疗效更佳。
(三)抗代谢药物:核酸合成的 "分子路障"
甲氨蝶呤(MTX)通过抑制二氢叶酸还原酶,阻断嘌呤和嘧啶核苷酸合成,主要用于鞘内注射预防中枢神经系统播散,剂量为 12-15mg/m²(每次),每周 1-2 次。依托泊苷(VP-16)则作用于拓扑异构酶 Ⅱ,导致 DNA 单链断裂,常与顺铂组成 EP 方案,用于高危组新辅助化疗,剂量为 100mg/m² 静脉滴注(第 1-3 天)。
(四)植物碱类:细胞骨架的 "分子破坏者"
长春新碱(VCR)通过结合微管蛋白,抑制纺锤体形成,阻断细胞分裂于 M 期,是 CCV 方案中的周期特异性药物,以 1.5mg/m²(最大剂量 2mg)静脉注射,每周 1 次,共 6-8 周。紫杉醇(PTX)较少一线使用,主要用于复发患者,通过促进微管聚合并抑制其解聚,导致细胞周期停滞,剂量为 135-175mg/m²,每 3 周一次。

三、基于危险分层的髓母细胞瘤化疗方案设计
(一)标准危险组(经典型,无转移,术后残留<1.5cm²):巩固强化策略
首选CCV 方案:洛莫司汀(第 1 天,110mg/m² 口服)+ 长春新碱(第 1、8、15、22 天,1.5mg/m² 静注)+ 顺铂(第 29 天,75mg/m² 静滴),每 6 周为 1 个疗程,共 6-8 个疗程。该方案在国际多中心研究中显示,可将 5 年无事件生存率提升至 75%-80%。需注意洛莫司汀的骨髓抑制具有累积性,每疗程前需监测血小板计数(需≥10 万 /μL)。

(二)高危组(间变型 / 大细胞型,转移或残留≥1.5cm²):高强度序贯策略
- 新辅助化疗:手术前给予 2-3 疗程 EP 方案(依托泊苷 100mg/m² d1-3 + 顺铂 75mg/m² d1),旨在降低肿瘤负荷,提高手术全切率。影像学评估显示,约 40% 的患者肿瘤体积可缩小 30% 以上。
- 术后同步放化疗:放疗期间给予低剂量长春新碱(1.5mg/m²,每周 1 次),增强放疗敏感性,此阶段需密切监测放射性食管炎与骨髓抑制的叠加毒性。
- 辅助强化疗:采用大剂量化疗 + 自体造血干细胞移植(HDC-ASCT),方案为环磷酰胺(1.5g/m² d1-2)+ 卡铂(AUC5 d3)+ 依托泊苷(500mg/m² d4),预处理后回输自体干细胞,每 4-6 周 1 次,共 2-3 疗程。该方案可使高危组 5 年总生存率从 50% 提升至 65%-70%,但需在具备造血干细胞移植资质的中心实施。
(三)特殊病理与分子亚型的调整策略
对于间变型 / 大细胞型或 MYC 扩增的 Group3 型肿瘤,需在 CCV 方案基础上联合蒽环类药物(如阿霉素 30mg/m² d1),形成CAV 方案(环磷酰胺 + 阿霉素 + 长春新碱),每 3 周 1 次,共 4-6 疗程。而 WNT 型患者因预后较好,可考虑减少化疗强度,采用单药长春新碱维持治疗,降低长期神经毒性风险。
四、髓母细胞瘤化疗疗程的精准计算与时间管理
(一)单疗程周期的构成要素
一个完整的化疗疗程包括三个阶段:
- 预处理期(1-3 天):完成血常规、肝肾功能、心电图等基线检查,评估骨髓储备(中性粒细胞≥1.5×10⁹/L,血小板≥100×10⁹/L);对于顺铂治疗患者,需提前 12 小时开始水化(生理盐水 2-3L/m²/d),预防急性肾损伤。
- 药物输注期(4-7 天):根据方案不同,输注时长差异显著。CCV 方案中,顺铂需持续静滴 6-8 小时(需配合止吐三联方案:5-HT3 受体拮抗剂 + 地塞米松 + NK-1 受体拮抗剂);长春新碱仅需 10 分钟静脉推注,但需避免外渗(建议中心静脉置管)。
- 骨髓恢复期(14-21 天):重点监测血细胞计数,粒细胞缺乏期(ANC<0.5×10⁹/L)通常出现在化疗后 7-10 天,需预防性使用粒细胞集落刺激因子(G-CSF),直至 ANC≥1.0×10⁹/L。
(二)总疗程数的临床决策
标准危险组6-8 疗程(每 6 周 1 次,总时长 7-9 个月),高危组8-12 疗程(含新辅助、同步、强化疗阶段,总时长 12-15 个月)。需注意:若化疗期间出现 Ⅲ-Ⅳ 度骨髓抑制(血小板<50×10⁹/L 或中性粒细胞<0.5×10⁹/L 持续>7 天),需延迟下一疗程并调整剂量(通常减量 20%),但累积剂量不足可能影响疗效,需在毒性与疗效间寻求平衡。
五、髓母细胞瘤化疗费用的多维度分析
(一)基础费用构成
- 药物费用:占总支出的 60%-70%。标准危险组 CCV 方案每疗程约 1.5-2.5 万元(洛莫司汀进口制剂约 8000 元 / 次,顺铂国产制剂约 2000 元 / 次),6 疗程总费用 9-15 万元;高危组 HDC-ASCT 单疗程约 10-15 万元(环磷酰胺 + 卡铂 + 干细胞处理费),3 疗程总费用 30-45 万元。靶向药物(如 SHH 通路抑制剂 vismodegib)若纳入方案,每月费用可达 8-10 万元,但目前主要用于复发试验性治疗。
- 支持治疗费用:包括止吐药物(帕洛诺司琼约 1500 元 / 次)、G-CSF(长效制剂约 2000 元 / 次)、静脉通路维护(PICC 置管及维护约 5000 元 / 疗程),占比约 20%-30%。
- 监测费用:每次疗程前的影像学评估(头颅 + 全脊髓 MRI 约 3000 元 / 次)、骨髓形态学检查(约 500 元 / 次),总费用随疗程增加呈线性增长。
(二)费用差异的影响因素

(三)医保与慈善救助
目前,顺铂、长春新碱、环磷酰胺等一线药物已纳入国家医保乙类,报销比例约 60%-70%(需根据当地政策);洛莫司汀、卡铂等药物部分地区医保覆盖。对于经济困难患者,可申请肿瘤患儿慈善基金(如 "向日葵儿童" 专项救助),最高可覆盖 40% 的自费部分。
六、髓母细胞瘤单次化疗的时间分配与流程管理
(一)日间化疗 vs 住院化疗
- 根据治疗强度选择给药场所:标准危险组的 CCV 方案第 1 天(洛莫司汀口服 + 长春新碱静注)可在日间病房完成(约 4 小时,含预处理评估);高危组的顺铂输注需住院 3-4 天(确保水化尿量≥3000ml/d,心电监护下密切监测电解质)。
(二)关键时间节点控制
- 止吐药物时序:帕洛诺司琼需在顺铂给药前 30 分钟静注,地塞米松需在化疗前 1 小时口服,形成 "预防性止吐窗口",将迟发性呕吐发生率从 70% 降至 20% 以下。
- 骨髓抑制监测:化疗后第 3、7、10、14 天需定期采血,若 ANC<1.0×10⁹/L,需启动 G-CSF 每日 5μg/kg,直至 ANC>1.5×10⁹/L(通常需 3-5 天)。
- 肝肾功能保护:顺铂给药后需每日监测肌酐清除率,若较基线下降>25%,下一疗程剂量需减至 60mg/m²;使用环磷酰胺时需同时给予美司钠(每 4 小时 1 次,共 3 次),预防出血性膀胱炎。
七、髓母细胞瘤化疗不良反应的分级管理与应对策略
(一)骨髓抑制:剂量调整的核心依据
采用 CTCAE 5.0 分级标准,Ⅲ 度以上抑制(血小板<50×10⁹/L 或中性粒细胞<0.5×10⁹/L)需启动干预:血小板<20×10⁹/L 时输注单采血小板;中性粒细胞<0.5×10⁹/L 超过 48 小时,需进行血培养并经验性使用碳青霉烯类抗生素(如亚胺培南 0.5g q8h)。重组人血小板生成素(TPO)可用于慢性血小板减少(<50×10⁹/L 持续>7 天),剂量为 300U/kg d1-14.
(二)神经毒性:长春新碱的剂量限制因素
表现为远端肢体麻木(感觉神经病变)、腱反射减弱(运动神经病变)及肠麻痹(自主神经病变),发生率约 30%-40%。当出现 Ⅱ 度以上神经毒性(无法独立行走或严重便秘),需暂停长春新碱直至症状缓解,复用时剂量减至 1.0mg/m²。维生素 B12(甲钴胺 0.5mg qd)和神经营养因子(如鼠神经生长因子)可改善症状,但需注意与紫杉醇类药物的神经毒性叠加风险。
(三)肾毒性:铂类药物的首要监护指标
顺铂的肾毒性具有剂量依赖性(累计剂量>400mg/m² 时风险显著升高),需在给药前后 6 小时内维持尿量>100ml/h,同时补充氯化钾(每日 3-4g)和镁剂(硫酸镁 2g 静滴)。基线肾功能不全患者(肌酐清除率<60ml/min)建议替换为卡铂(按 AUC 计算剂量,肾毒性风险降低 50%)。
(四)远期毒性:儿童患者的特殊考量
长期随访显示,接受含烷化剂方案的患儿,10 年后第二原发肿瘤风险较常人升高 3-5 倍(主要为急性髓系白血病和骨髓增生异常综合征),需每年进行骨髓穿刺 + 染色体核型分析。此外,顺铂的耳毒性可能导致高频听力损失(发生率约 15%-20%),建议每疗程前进行纯音测听,≥30dB 听力下降者需调整铂类药物剂量。
八、髓母细胞瘤化疗期间的全程管理要点
(一)营养支持的黄金法则
遵循 "高热量、高蛋白、易消化" 原则,每日热量摄入需达 25-30kcal/kg(如体重 30kg 患儿需 750-900kcal/d)。出现严重黏膜炎时,可给予要素饮食(如瑞素 1.0kcal/ml,分次鼻饲),必要时静脉营养(葡萄糖 + 脂肪乳 + 氨基酸,热氮比 150:1)。需注意,洛莫司汀可能导致迟发性恶心(服药后 6-12 小时),建议睡前服用并配合长效止吐剂。
(二)静脉通路的优选策略
推荐使用植入式静脉港(PORT)或 PICC 导管,减少外周静脉损伤。PORT 适用于需长期化疗(>6 个月)的患儿,感染率低于 PICC(约 2%-5% vs 5%-10%),但维护成本较高(每次冲管约 200 元)。PICC 导管需每周维护,注意避免导管相关性血栓(发生率约 8%-12%),出现上肢肿胀时需立即行血管超声检查。
(三)心理社会支持体系构建
建立 "医患家庭三角沟通模式",每次化疗前预留 30 分钟进行方案讲解,使用可视化工具(如化疗周期日历、不良反应自查表)提高治疗依从性。针对儿童患者,可引入游戏治疗(如医疗角色扮演)减轻穿刺恐惧,必要时联合儿童心理科进行认知行为干预,降低化疗相关焦虑障碍的发生率(据统计,未干预组焦虑发生率达 45%,干预后降至 18%)。
延伸问答:髓母细胞瘤化疗相关热点问题解析
(一)化疗期间出现严重感染还能继续治疗吗?
需根据感染严重程度分级处理:Ⅰ-Ⅱ 度感染(如局限于上呼吸道的病毒感染),在控制症状后可继续化疗(推迟 3-5 天,同时加强 G-CSF 支持);Ⅲ-Ⅳ 度感染(如肺炎、败血症)需暂停化疗直至感染控制(体温正常≥72 小时,炎症指标 CRP<10mg/L),复治时剂量减至原方案的 80%,并预防性使用抗生素(如复方新诺明 2mg/kg qd)直至化疗结束。
(二)儿童患者化疗后生长发育会受哪些影响?
烷化剂和铂类药物可能损伤垂体 - 性腺轴,导致生长激素缺乏(发生率约 20%-30%)和性发育延迟(女孩>13 岁初潮、男孩>14 岁睾丸发育)。建议化疗结束后每 6 个月监测身高、体重、骨龄(左手腕 X 线)及性激素水平(FSH、LH、雌二醇 / 睾酮),生长速率<5cm / 年时需启动生长激素替代治疗(0.15-0.2mg/kg/d 皮下注射)。
(三)新型靶向药物能否替代传统化疗?
目前靶向治疗(如 SHH 通路抑制剂、MYC 抑制剂)尚处于临床试验阶段,主要用于复发或难治性病例,客观缓解率约 30%-40%,无法完全替代传统化疗。但对于携带特定分子标志物的患者(如 SHH 型的 PTCH1 突变),可在化疗基础上联合靶向药物,形成 "精准鸡尾酒疗法",未来随着分子分型技术的普及,化疗方案将更趋个体化。
(四)化疗后多久可以评估疗效?
建议在每 2 个疗程后进行影像学评估(头颅 + 全脊髓 MRI 增强扫描),采用 RECIST 1.1 标准判断疗效:完全缓解(CR)需所有病灶消失且脑脊液细胞学阴性;部分缓解(PR)需肿瘤直径总和缩小≥30%;疾病稳定(SD)为缩小<30% 或增大<20%;疾病进展(PD)为增大≥20% 或出现新病灶。疗效评估需由神经影像科与肿瘤内科联合解读,避免单一科室判断偏差。

结语
髓母细胞瘤的化疗是一场精密的 "生化战役",每一种药物都是精心挑选的 "武器",每一个疗程都是量体裁衣的 "战术组合"。从药物机制的精准把握到方案选择的个体化决策,从费用管理的理性规划到不良反应的科学应对,每一个环节都需要医患之间的深度协作。随着分子分型技术的进步与新型药物的研发,化疗正从 "细胞毒性打击" 向 "精准靶向调控" 转型,但不变的是对 "疗效最大化、毒性最小化" 的永恒追求。对于患者和家属而言,理解化疗的科学逻辑,积极参与治疗管理,保持与医疗团队的开放沟通,是打赢这场抗癌战争的关键砝码。在医学科技与人文关怀的双重护航下,越来越多的髓母细胞瘤患者正走向长期生存,续写生命的新篇章。
- 文章标题:髓母细胞瘤化疗全解析:药物、方案、疗程与管理策略
- 更新时间:2025-05-09 17:41:30

 400-029-0925
400-029-0925