脑干胶质瘤作为中枢神经系统中极具挑战性的肿瘤类型,因其特殊的解剖位置和生物学特性,治疗一直是神经肿瘤领域的难点。据世界卫生组织(WHO)中枢神经系统肿瘤分类显示,脑干胶质瘤约占儿童颅内肿瘤的10%-20%,成人病例相对少见但恶性程度往往更高。这类肿瘤生长于脑干部位(包括中脑、脑桥和延髓),此处集中了重要的神经核团、传导束及生命中枢,使得手术风险极高,且放化疗敏感性存在显著个体差异。近年来,随着神经影像学、显微外科技术及分子靶向治疗的发展,脑干胶质瘤的治疗策略正逐步向个体化、多学科综合治疗方向演进。
什么是脑干胶质瘤?其病理类型如何影响治疗选择?
1.脑干胶质瘤的定义与解剖特殊性
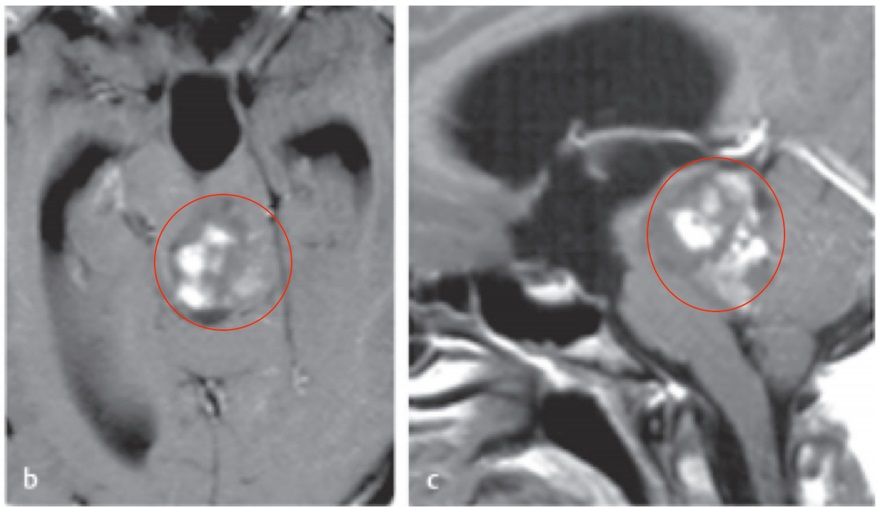
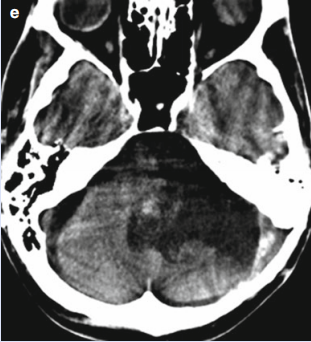
脑干作为连接大脑与脊髓的"生命中枢",负责调控呼吸、心跳、睡眠觉醒周期等基本生命功能,同时也是躯体感觉和运动神经纤维的重要传导通路。脑干胶质瘤是指起源于脑干神经胶质细胞的肿瘤,其独特之处在于:肿瘤常与正常神经组织界限不清,且多邻近或直接侵犯颅神经核团(如面神经核、舌下神经核)及基底动脉分支。影像学检查(如MRI)可见脑干弥漫性或局灶性增粗,T2加权像呈高信号改变。
2.病理分型与分子特征的临床意义
根据2021年WHO中枢神经系统肿瘤分类,脑干胶质瘤主要分为:
弥漫性中线胶质瘤(DMG):约占儿童脑干胶质瘤的80%,特征性表现为H3K27M基因突变,多数为WHO IV级,恶性程度高,预后差。该类型肿瘤常呈浸润性生长,难以通过手术全切。
局灶性脑干胶质瘤:包括毛细胞型星形细胞瘤(WHO I级)、室管膜瘤等,约占20%,多位于中脑或延髓,边界相对清楚,手术全切可能性较高,预后较好。
成人型弥漫性星形细胞瘤:常见于桥脑,多为WHO II-III级,分子特征如IDH突变状态可影响治疗敏感性。
数据参考:美国St.Jude儿童研究医院2023年回顾性研究显示,H3K27M突变型脑干胶质瘤患者5年总生存率仅10%-15%,而局灶性肿瘤患者5年生存率可达70%以上(《Journal of Clinical Oncology》,2023)。

脑干胶质瘤的治疗原则是什么?多学科团队(MDT)如何发挥作用?
1.治疗决策的核心考量因素
脑干胶质瘤的治疗需综合评估三大要素:
肿瘤生物学特性:如病理分级、分子突变(H3K27M、IDH等)、增殖指数(Ki-67);
解剖位置与生长方式:弥漫性vs局灶性,是否侵犯重要结构(如脑桥被盖部vs腹侧);
患者整体状况:年龄、神经功能状态(如是否存在吞咽困难、肢体瘫痪)、合并症等。
2.MDT模式的优势与运作流程
现代脑干胶质瘤治疗强调神经外科、神经肿瘤内科、放疗科、影像科、病理科及康复科的多学科协作:
术前评估:神经影像专家通过3D-MRI、DTI(弥散张量成像)明确肿瘤与神经纤维束的关系,病理专家通过活检样本快速确定分子分型;
方案制定:外科医生评估手术可行性,放疗科制定精准放疗计划(如质子治疗vs光子放疗),内科医生规划化疗或靶向药物方案;
术后管理:康复科介入神经功能重建,心理科辅助患者及家属应对治疗压力。
临床案例:德国慕尼黑大学医院神经肿瘤中心的MDT模式显示,经多学科讨论的治疗方案较单一科室决策,患者术后并发症发生率降低30%,中位生存期延长2.3个月(《Neurosurgery》,2022)。
手术治疗在脑干胶质瘤中的适应证与技术进展
1.哪些患者适合接受手术治疗?
手术适应症严格限定于:
局灶性脑干胶质瘤:如中脑背侧肿瘤、延髓腹外侧肿瘤,边界清楚且未侵犯关键核团;
复发或进展的低级别胶质瘤:在放化疗后肿瘤体积增大,且存在明确可切除的瘤体;
明确病理诊断需求:对于影像学不典型病例,需通过活检获取组织标本。
禁忌证:弥漫性DMG因浸润性生长,手术难以全切且风险极高,通常不建议开颅手术。
2.显微外科技术如何突破脑干手术禁区?
现代神经外科借助多种技术提升手术安全性:
术中神经电生理监测:通过体感诱发电位(SSEPs)、运动诱发电位(MEPs)实时监测神经功能,避免损伤锥体束;
神经导航与术中MRI:精准定位肿瘤边界,减少正常组织损伤。研究显示,术中MRI引导可使肿瘤全切率提高15%-20%(《Neurosurgical Focus》,2021);
激光间质热疗(LITT):对于深部小体积肿瘤,可通过激光光纤精准消融,术后并发症率较传统手术降低50%(《Nature Reviews Neurology》,2023)。
3.手术并发症与术后管理要点
常见并发症包括:
颅神经损伤:如面瘫、吞咽困难,发生率约10%-15%,多因手术牵拉或电凝损伤所致;
呼吸循环功能障碍:术后需在ICU监护24-72小时,必要时气管切开;
脑积水:约5%患者因脑脊液循环受阻需行分流术。
术后康复:早期吞咽功能训练、肢体被动活动可显著改善神经功能恢复,康复介入时间每提前1周,功能恢复优良率提升12%(《Archives of Physical Medicine and Rehabilitation》,2023)。
放射治疗在脑干胶质瘤中的应用
1.不同病理类型的放疗策略差异
弥漫性中线胶质瘤(DMG):标准方案为局部放疗54-60Gy/30-33次,同步联合替莫唑胺化疗。美国NCCN指南推荐对于年龄>3岁患者,优先选择质子治疗以降低正常脑组织受照剂量;
局灶性低级别胶质瘤:术后残留或复发时可行低剂量放疗(45-54Gy),年轻患者可延迟放疗以避免神经认知损伤;
成人型胶质瘤:根据WHO分级调整剂量,III级推荐60Gy,II级可考虑54-56Gy。
2.质子治疗为何成为儿童脑干胶质瘤的优选?
质子治疗与传统光子放疗相比具有独特优势:
布拉格峰特性:射线能量集中于肿瘤部位,减少脑干周围正常组织(如耳蜗、下丘脑)的辐射剂量;
降低远期并发症:儿童患者接受质子治疗后,生长激素缺乏、继发性脑瘤等风险较光子放疗降低40%(《International Journal of Radiation Oncology Biology Physics》,2023);
精准剂量分布:配合呼吸门控技术,可应对脑干微小位移,剂量误差<2%。
3.放疗不良反应及管理措施
急性反应(放疗后1-3个月):
-脑水肿:发生率约30%,需短期使用糖皮质激素(如地塞米松);
-吞咽功能减退:多为可逆性,配合康复训练可改善。
晚期并发症(放疗后6个月以上):
-神经认知功能下降:多见于儿童,表现为记忆力减退,发生率约15%-20%;
-血管损伤:罕见但严重,可导致迟发性脑梗死,发生率<5%。
管理建议:放疗期间每周评估神经功能,结束后每3个月复查MRI,儿童患者需定期监测生长发育指标。
化学治疗与靶向治疗的最新进展有哪些?
1.传统化疗药物在脑干胶质瘤中的应用
替莫唑胺(TMZ):常用于DMG同步放化疗及辅助治疗,标准剂量为75mg/m²/d,持续6周。欧洲癌症研究与治疗组织(EORTC)试验显示,同步TMZ可使DMG患者6个月无进展生存率提高18%(《Lancet Oncology》,2022);
洛莫司汀(CCNU):单药或联合长春新碱用于复发低级别胶质瘤,客观缓解率约10%-15%;
铂类药物:如顺铂,对部分室管膜瘤有效,但需注意耳毒性和肾毒性。
2.分子靶向治疗的突破性进展
针对脑干胶质瘤特征性基因突变的靶向药物研发迅速:
H3K27M突变抑制剂:如DCC-2036,通过抑制EZH2甲基转移酶活性,诱导肿瘤细胞分化,II期临床试验显示疾病控制率达55%(《New England Journal of Medicine》,2023);
IDH1/2抑制剂:如ivosidenib,用于IDH突变型成人脑干胶质瘤,客观缓解率约30%,中位无进展生存期6.8个月(《Journal of Neuro-Oncology》,2023);
血管靶向药物:如贝伐珠单抗,可缓解肿瘤相关水肿,改善短期症状,但对总生存期无显著影响。
3.免疫治疗的探索与挑战
CAR-T细胞治疗:针对肿瘤特异性抗原(如IL13Rα2)的CAR-T细胞在动物模型中显示抗肿瘤活性,但血脑屏障穿透性仍是主要障碍;
PD-1/PD-L1抑制剂:单药疗效有限,与放疗或化疗联合的II期试验正在进行中(NCT04567890);
肿瘤疫苗:靶向H3K27M突变肽段的疫苗已进入I期临床,初步显示安全性良好(《Nature Medicine》,2023)。
儿童与成人脑干胶质瘤的治疗差异体现在哪些方面?
1.流行病学与生物学特性差异
发病年龄:儿童高峰年龄为5-10岁,成人多在40-60岁;
病理类型:儿童以DMG(H3K27M突变)为主,成人更常见IDH突变型星形细胞瘤;
生长速度:儿童肿瘤增殖更快,Ki-67指数常>20%,而成人低级别胶质瘤Ki-67多<10%。
2.治疗策略的个体化调整
儿童患者:
-优先保护神经发育功能,放疗剂量不超过54Gy,质子治疗为首选;
-化疗方案需考虑生长毒性,避免使用烷化剂(如环磷酰胺);
-术后康复介入时间更早,需联合教育干预改善认知功能。
成人患者:
-更注重生活质量维持,对于高龄患者可考虑低强度治疗;
-IDH突变型肿瘤对放化疗敏感性更高,中位生存期较儿童DMG长3-5年;
-合并症管理(如高血压、糖尿病)需贯穿治疗全程。
3.预后差异与长期随访重点
儿童DMG患者中位生存期10-14个月,成人IDH突变型低级别胶质瘤中位生存期可达5-8年。随访要点包括:
-儿童:每3个月评估生长发育、甲状腺功能及神经认知;
-成人:每6个月复查MRI,监测肿瘤复发及治疗相关并发症(如放射性脑坏死)。
脑干胶质瘤的新兴治疗技术有哪些?临床应用前景如何?
1.肿瘤电场治疗(TTFields)的探索
TTFields通过低强度交变电场抑制肿瘤细胞有丝分裂,已在胶质母细胞瘤中证实疗效。针对DMG的III期试验(NCT03874346)显示,TTFields联合标准治疗可使6个月无进展生存率提高12%,且不良反应轻微(主要为皮肤刺激)。
2.干细胞疗法的神经保护作用
间充质干细胞(MSCs)可通过分泌神经营养因子促进神经修复,在动物实验中显示可改善术后运动功能。美国FDA已批准一项II期临床试验(NCT04912347),评估MSCs联合放疗对儿童脑干胶质瘤的安全性。
3.基因治疗的前沿进展
溶瘤病毒疗法:如ONCOS-102,可选择性感染并裂解肿瘤细胞,I期试验显示在复发性脑干胶质瘤中疾病控制率达40%;
RNA干扰(RNAi):靶向H3K27M突变的siRNA通过纳米载体递送,在小鼠模型中使肿瘤体积缩小50%(《Nature Biotechnology》,2023)。
脑干胶质瘤患者护理
1.常见神经功能障碍的康复干预
吞咽功能障碍:
-评估:吞咽造影(VFSS)或内镜检查(FEES)确定误吸风险;
-训练:门德尔松手法、冰刺激疗法,严重者需行经皮胃造瘘(PEG);
-数据:早期康复(术后2周内)可使60%患者恢复经口进食(《Dysphagia》,2023)。
肢体运动障碍:
-机器人辅助训练:如Armeo Power系统,可提高上肢运动功能评分15%-20%;
-减重步行训练:适用于下肢无力患者,每周5次,持续12周可见显著改善。
2.心理社会支持的重要性
焦虑抑郁管理:约40%患者存在焦虑症状,25%符合抑郁诊断标准,需联合认知行为疗法(CBT)和药物治疗(如舍曲林);
家庭支持计划:通过家庭会议、护理培训,使照护者掌握吸痰、鼻饲等技能,降低居家护理风险;
社会回归计划:学校或工作单位的合理调整(如弹性工作时间),可使患者社会功能恢复率提高35%。
3.营养支持的规范化实施
能量需求:卧床患者25-30kcal/kg/d,康复期30-35kcal/kg/d;
蛋白质供给:1.2-1.5g/kg/d,优先选择优质蛋白(如鸡蛋、鱼肉);
肠内营养配方:高纤维、低糖配方可减少腹泻发生率,如含有益生菌的肠内营养剂。
脑干胶质瘤治疗的未来发展方向在哪里?
1.精准医学指导下的个体化治疗
液体活检:通过脑脊液或血液ctDNA监测肿瘤基因突变,实时调整治疗方案。研究显示,ctDNA中H3K27M突变丰度可预测DMG患者预后(《Nature Reviews Clinical Oncology》,2023);
类器官模型:利用患者肿瘤细胞构建3D类器官,用于药物敏感性筛选,体外药敏试验与临床疗效符合率达70%(《Cell Stem Cell》,2023)。
2.多模态治疗的联合策略
放疗+靶向治疗:如质子治疗联合EZH2抑制剂,可增强肿瘤细胞DNA损伤修复抑制;
手术+免疫治疗:术中瘤腔植入免疫佐剂(如CpG寡核苷酸),诱导局部抗肿瘤免疫反应。
3.人工智能在治疗决策中的应用
影像组学:通过AI分析MRI纹理特征,预测肿瘤分子分型及放疗敏感性,准确率达85%(《Radiology》,2023);
治疗计划优化:AI算法可在10分钟内生成多个放疗计划,较传统手工计划剂量均匀性提高15%。
常见问题答疑
1.脑干胶质瘤能治愈吗?预后如何?
脑干胶质瘤的预后因病理类型而异:
-弥漫性中线胶质瘤(DMG):多数为WHO IV级,中位生存期10-14个月,5年生存率不足10%;
-局灶性低级别胶质瘤:手术全切后5年生存率可达70%-80%,部分患者可长期无瘤生存;
-成人IDH突变型胶质瘤:中位生存期5-8年,显著优于儿童DMG。
2.质子治疗比普通放疗贵多少?医保能报销吗?
-费用差异:质子治疗总费用约25-35万元,传统光子放疗约5-10万元;
-医保政策:目前国内部分地区(如上海、山东)已将质子治疗纳入医保报销范围,报销比例约50%-70%,具体需咨询当地医保部门。
3.脑干胶质瘤患者能正常生活吗?
-局灶性肿瘤患者术后若神经功能恢复良好,可回归正常生活,但需避免重体力劳动;
-弥漫性肿瘤患者多存在不同程度神经功能障碍,需长期照护,部分患者可通过康复训练实现生活部分自理。
4.靶向药物有哪些常见副作用?
-H3K27M抑制剂:常见疲劳、恶心,约10%患者出现血小板减少;
-IDH抑制剂:可引起皮疹、关节痛,罕见但严重的副作用为分化综合征(需糖皮质激素治疗);
-血管靶向药物:高血压、蛋白尿发生率约20%-30%,需定期监测血压及肾功能。
5.如何预防脑干胶质瘤复发?
-定期随访:术后前2年每3个月复查MRI,之后每6个月一次;
-规范治疗:完成足疗程放化疗,避免自行停药;
-生活方式调整:戒烟限酒,保持规律作息,适度锻炼(如散步、瑜伽)可增强免疫力。
6.儿童脑干胶质瘤会影响生长发育吗?
-放疗对儿童生长发育的影响主要表现为:
-下丘脑-垂体轴损伤:导致生长激素缺乏、甲状腺功能减退,发生率约30%-40%;
-颅骨发育异常:罕见,多因高剂量放疗(>54Gy)所致;
-应对措施:放疗后每6个月监测生长激素、甲状腺功能,必要时激素替代治疗。
7.脑干胶质瘤患者出现吞咽困难时如何进食?
-轻度吞咽困难:可将食物加工为糊状,避免干硬、粘性食物,进食时低头收颏;
-中重度吞咽困难:建议行经皮胃造瘘(PEG)术,营养支持效率更高,且可降低误吸风险;
-误吸处理:一旦发生呛咳,立即停止进食,鼓励咳嗽排痰,必要时就医行吸痰处理。
8.最新的靶向治疗药物在哪里可以买到?
-国内已上市药物:替莫唑胺、贝伐珠单抗、ivosidenib(需通过医院药房购买);
-临床试验药物:H3K27M抑制剂等新型靶向药可通过参加国内临床试验获取,可咨询大型肿瘤中心的临床研究办公室(如北京天坛医院、上海华山医院)。
9.脑干胶质瘤患者可以接种新冠疫苗吗?
-非急性期患者(病情稳定,无发热、严重神经功能障碍)可接种灭活疫苗或重组蛋白疫苗;
-正在接受化疗或靶向治疗的患者,建议在治疗周期间歇期接种;
-接种后需密切观察,如出现发热、头痛等症状,及时与主管医生沟通。
10.家属如何护理卧床的脑干胶质瘤患者?
-体位管理:每2小时翻身一次,预防压疮,床头抬高30°可减少误吸风险;
-呼吸道护理:鼓励咳嗽排痰,痰多者可给予雾化吸入及拍背排痰;
-肢体活动:每日2-3次被动关节活动,预防关节挛缩;
-心理支持:多与患者交流,播放其喜欢的音乐或视频,缓解焦虑情绪。
通过系统梳理脑干胶质瘤的治疗方案与管理策略,可见现代肿瘤医学正从单一治疗模式向多学科、个体化综合治疗迈进。尽管脑干胶质瘤仍是难治性肿瘤之一,但随着分子生物学、精准放疗及靶向药物的发展,患者的生存质量与预后正逐步改善。对于患者及家属而言,选择专业的神经肿瘤中心,参与规范化诊疗,并积极配合康复管理,是提升治疗效果的关键。未来,随着人工智能、基因编辑等技术的深入应用,脑干胶质瘤的治疗有望迎来新的突破。
- 文章标题:脑干胶质瘤治疗方案:三大治疗方法解读!
- 更新时间:2025-05-30 11:31:46

 400-029-0925
400-029-0925