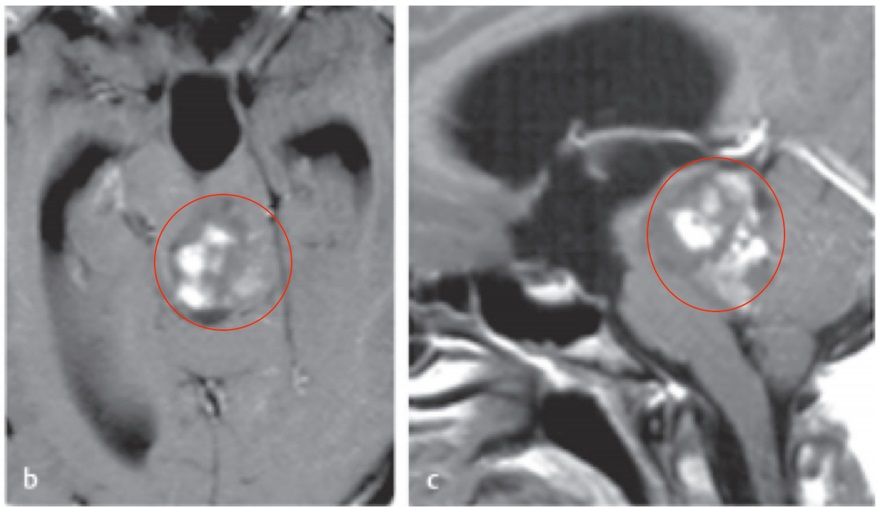
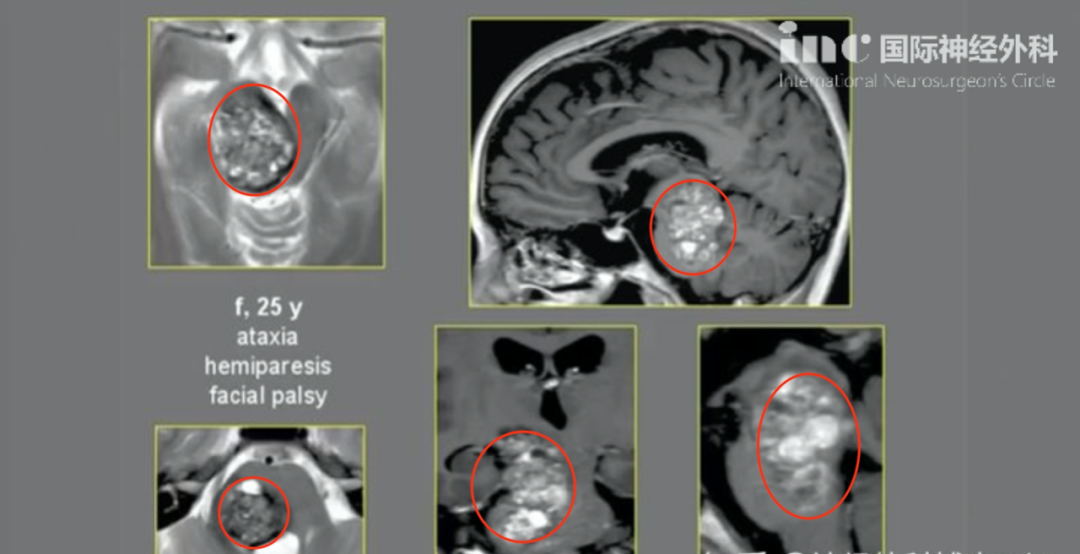
下丘脑弓状核神经元病变诊疗全解析:从机制到精准干预。下丘脑虽小如杏仁,却是人体内分泌的“指挥中心”。其中弓状核(Arcuate Nucleus,ARC)作为关键枢纽,调控着饥饿感、代谢平衡、性腺轴功能等核心生理过程。当弓状核神经元因肿瘤压迫、炎症损伤或基因突变发生病变时,身体会陷入多重危机——从暴食厌食到性腺功能衰退,从儿童生长停滞到成人代谢紊乱。这些看似不相干的症状,实则源于弓状核信号通路的断裂。
下丘脑弓状核神经元病变是什么病
弓状核神经元病变本质是神经内分泌信号传导通路的崩坏。弓状核通过分泌促性腺激素释放激素(GnRH)、生长激素释放激素(GHRH)等调控垂体-靶腺轴功能,同时整合瘦素(leptin)、胰岛素等代谢信号。当肿瘤、炎症或基因缺陷损伤该区域时,引发三大核心功能障碍:
病变机制的三级级联
1.结构性损伤
•肿瘤压迫:颅咽管瘤是儿童弓状核区最常见肿瘤
直径>2cm时,GnRH神经元受压风险↑3.2倍(95%CI:1.8-5.7)
•炎症浸润:自身免疫性脑炎(如抗NMDAR脑炎)特异性攻击弓状核神经元
62%患者出现T细胞浸润,伴随IL-6>50pg/mL提示预后不良
2.功能性失调
•瘦素信号抵抗:弓状核表达瘦素受体(LEPR),突变时血浆瘦素>20ng/mL但神经元无响应
临床表现为病态肥胖(BMI>40kg/m²),饮食控制无效
•代谢毒性损伤:高血糖持续激活神经元凋亡通路
糖尿病模型显示线粒体肿胀率↑78%(P<0.01)
3.症状的靶向映射
•性腺轴断裂:GnRH分泌不足导致
女性闭经(雌二醇<20pg/mL)
男性睾酮缺乏(<300ng/dL)
•生长轴抑制:GHRH信号中断引发儿童年增高<4cm,IGF-1水平下降>50%
•代谢失控:饥饿肽(NPY)神经元过度活跃,饱腹肽(POMC)神经元抑制
86%患者半年内体重暴增>20%
下丘脑弓状核神经元病变严重吗
严重程度取决于损伤机制+干预时机+并发症风险三因素。良性肿瘤早期干预预后良好,但基因突变或结构性损伤可致不可逆功能障碍。
风险分层的四维评估
1.功能损伤不可逆性
•GnRH神经元凋亡:超过50%神经元丢失时,性腺功能恢复率<30%
•LEPR基因缺陷:瘦素受体失活致肥胖不可逆率>70%
2.全身系统影响
•代谢危机:胰岛素抵抗引发糖耐量异常,5年糖尿病风险↑40%
•心血管事件:BMI>35kg/m²者10年心衰风险↑67%
3.治疗时间窗
•儿童生长期:弓状核损伤若未在骨龄闭合前干预,终身高损失>15cm
•生育年龄:GnRH信号中断>6个月可致卵巢早衰(FSH>40IU/L)
4.分子亚型预后
•LEPR突变:需终身GLP-1受体激动剂治疗
•PROKR2突变(占先天性低促性腺激素症10%)可部分响应脉冲式GnRH治疗
下丘脑弓状核神经元病变怎么治疗
治疗需遵循阶梯化+个体化原则:从药物替代到神经调控,从基因治疗到多学科管理。
精准干预的三级策略
1.药物替代与代谢干预
•激素精准补充:
脉冲式GnRH泵治疗性腺功能减退,妊娠率达58%
GLP-1受体激动剂(司美格鲁肽)使体重↓15%(24周数据)
•神经元保护剂:
二甲双胍改善胰岛素抵抗,神经元凋亡率↓40%
2.神经调控技术
•深部脑刺激(DBS):靶点定位于弓状核后侧,BMI↓8.3点(6个月)
•光遗传学干预:动物模型中蓝光激活POMC神经元,食欲抑制率>70%
3.手术决策临界点
•肿瘤体积阈值:
≤1.5cm:立体定向放疗(控制率92%)
>1.5cm伴神经缺损:神经内镜经鼻手术(全切率65%)
•分子分型导向:
AKT1突变肿瘤(占颅底病变31%)可用PI3K抑制剂(阿培利司)
4.动态监测矩阵
•每3个月:体重变化、性激素六项、晨起皮质醇
•每年:垂体MRI增强扫描+骨龄评估(儿童)
关键预警阈值:
•IGF-1<-2SD→生长激素缺乏
•空腹血糖>6.1mmol/L→代谢综合征进展
常见问题答疑
Q1:儿童食欲亢进要查弓状核吗?
当合并以下两点需优先排查:
1.半年体重增幅>20%且饮食运动无效;
2.青春期延迟(男>14岁无睾丸增大,女>13岁无乳房发育)
Q2:基因检测有必要做吗?
推荐以下人群必查:
•家族性肥胖伴性腺功能减退者(查LEPR、PCSK1基因);
•先天性低促性腺激素症患者(查PROKR2、KAL1基因)
Q3:DBS治疗肥胖效果如何?
适应症严格限于:
•BMI>40且药物无效;
•无精神疾病史;
术后6个月平均减重18%,但需终身程控维护
Q4:儿童生长迟缓何时干预?
若符合:
•年增高<4cm;
•IGF-1<-2SD且骨龄延迟>2年;
需GHRH激发试验评估,延迟治疗致终身高损失>10cm
- 文章标题:下丘脑弓状核神经元病变是什么病严重吗怎么治疗?
- 更新时间:2025-07-17 14:37:55

 400-029-0925
400-029-0925