侧脑室作为大脑内部的腔隙结构,其前角区域的原发病变一直是神经外科领域的重要研究方向。当人体侧脑室前角出现异常增生或结构性改变时,往往会引发一系列神经功能异常。许多患者在体检或因症状就诊时发现此类病变,随之而来的疑问是:这些病变究竟是什么?是否会对健康造成严重威胁?
侧脑室前角原发病变的解剖学基础与定义
(1)侧脑室前角的解剖定位
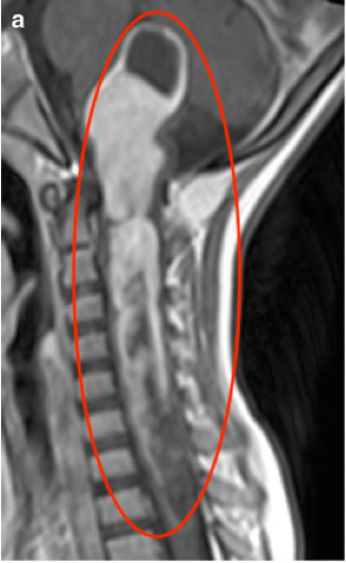
侧脑室前角是侧脑室延伸至大脑额叶的部分,其边界由胼胝体膝部(前上方)、尾状核头(外侧)、透明隔(内侧)及前连合(后下方)共同构成。这一区域并非孤立存在,而是与内囊前肢、基底节区等重要结构相邻,因此病变易累及周边神经纤维束或核团。从影像学角度看,头颅CT或MRI上的侧脑室前角呈对称的尖端向前的三角形,是评估颅内病变位置的关键解剖标志。
(2)原发病变的医学界定
“原发病变”指起源于侧脑室前角局部组织的异常改变,而非其他部位病变的转移或继发性累及。其病理基础可涉及神经上皮组织、间质细胞、血管结构或胚胎残留组织等。与继发性病变(如脑实质肿瘤向脑室侵犯)不同,原发病变的生长起点位于侧脑室前角及其衬里结构,这一特性决定了其独特的临床演变规律和治疗策略。

常见病理类型及流行病学特征
(1)神经上皮源性肿瘤
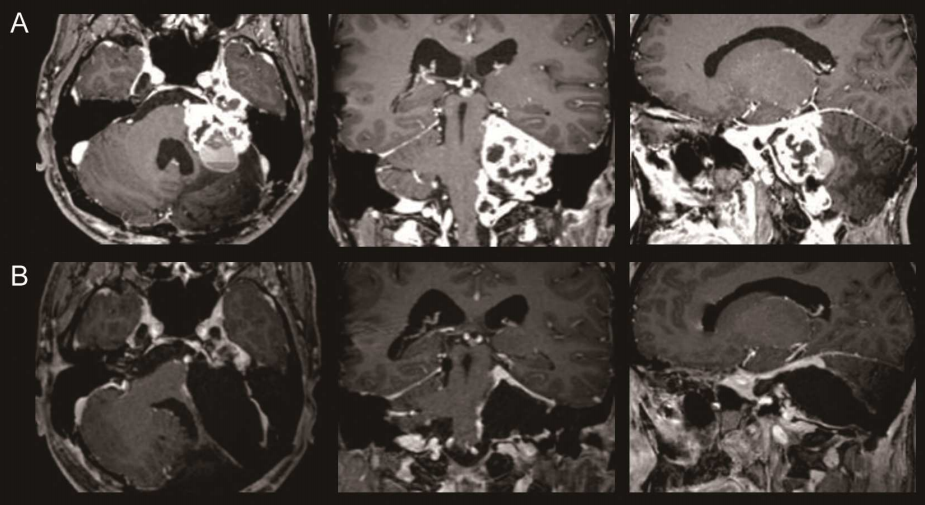
室管膜瘤:约占侧脑室前角原发肿瘤的30%,起源于室管膜细胞,多见于儿童及青少年。WHO病理分级中,Ⅱ级黏液乳头型室管膜瘤在侧脑室前角较为常见,影像学表现为边界较清的结节状强化病灶,易阻塞脑脊液循环通路引发脑积水。
星形细胞瘤:以低级别(WHOⅠ-Ⅱ级)为主,如毛细胞型星形细胞瘤,生长缓慢,常呈囊性变。据《Neurology》2023年全球脑瘤统计报告,侧脑室前角星形细胞瘤占颅内星形细胞瘤的5.7%,好发于20-40岁人群。
少突胶质细胞瘤:约占该区域肿瘤的15%,特征性表现为染色体1p/19q共缺失,对放化疗敏感,影像学可见钙化灶。
(2)非肿瘤性病变
室管膜下囊肿:属于先天性发育异常,尸检研究显示其发生率约为1.2%-3.5%(《Journal of Neurology》2021),多为无症状性,囊肿直径通常<1cm,无需特殊处理。
海绵状血管瘤:由异常扩张的血管腔隙构成,占侧脑室前角血管性病变的60%以上,破裂出血时可引发急性神经功能缺损,如偏瘫或意识障碍。
脉络丛乳头状瘤:好发于儿童,占侧脑室前角肿瘤的8%-10%,因过度分泌脑脊液可导致交通性脑积水,手术全切后预后良好。
(3)特殊类型病变
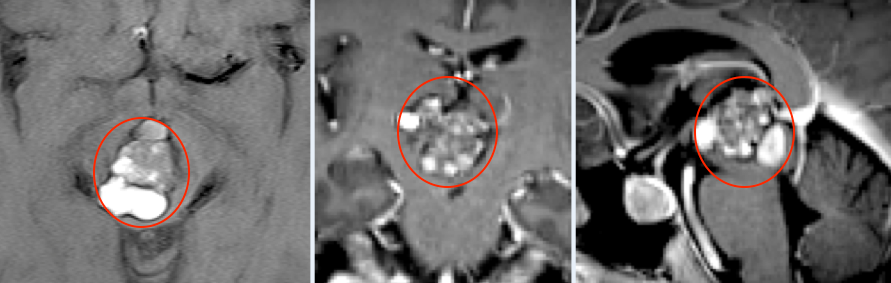
中枢神经细胞瘤:WHOⅡ级,多见于青年(20-40岁),影像学呈“蜂窝状”混杂信号,免疫组化显示NeuN阳性,手术联合放化疗后5年生存率超90%(《Neurosurgery》2019数据)。
胚胎发育不良性神经上皮肿瘤(DNET):属于良性癫痫相关肿瘤,儿童期起病,临床以药物难治性癫痫为主要表现,手术切除后癫痫控制率达85%以上。
病变严重性评估:从病理到临床的多维判断
(1)病理分级与生物学行为
-低级别病变(如WHOⅠ-Ⅱ级肿瘤、囊肿):生长缓慢,边界清晰,较少浸润周围脑组织,若未压迫重要结构,多数患者可长期带瘤生存。例如室管膜下囊肿,约87%的病例终身无需干预(《Neuroradiology》2020随访研究)。
-高级别病变(如间变性室管膜瘤、胶质母细胞瘤):具有侵袭性,易通过脑脊液播散,中位生存期仅14-18个月(参考NCCN中枢神经系统肿瘤指南2024版),需积极综合治疗。
(2)解剖位置的压迫效应
侧脑室前角毗邻内囊前肢(管理对侧肢体运动)和前额叶联络纤维(涉及认知、情绪调控),因此病变即使体积较小(如>1.5cm)也可能引发:
运动障碍:约42%的患者出现对侧肢体肌力减弱(《Journal of Neurosurgery》2022临床分析);
认知改变:表现为注意力下降、执行功能减退,与前额叶皮质受压相关;
脑积水症状:当病变阻塞室间孔时,可出现头痛、呕吐、视乳头水肿,急性梗阻者可致意识障碍。
(3)特殊人群的风险差异
儿童患者:因脑组织处于发育阶段,病变易影响神经可塑性,即使良性肿瘤也可能导致远期认知功能损害。研究显示,儿童侧脑室前角肿瘤术后出现学习障碍的概率为成人的2.3倍(《Pediatric Neurology》2023)。
老年患者:合并脑萎缩时,病变耐受性稍强,但术后并发症(如肺炎、深静脉血栓)发生率较中青年高15%-20%(《Geriatric Neurosurgery》2021数据)。
诊断流程:从症状识别到精准评估
(1)常见临床表现
颅内压增高症状:头痛(晨起加重)、呕吐、视物模糊,约65%-80%的占位性病变患者出现该类症状(《Neurology Clinics》2023综述);
局灶性神经功能缺损:包括对侧肢体轻瘫、感觉异常,或语言障碍(优势半球受累时);
癫痫发作:多见于皮质受累的病变,如DNET或低级别星形细胞瘤,发作形式以复杂部分性发作为主。
(2)影像学检查体系
头颅MRI:为首选检查,T1加权像可显示病变与周围结构的关系,T2/FLAIR序列能发现水肿带,增强扫描有助于鉴别肿瘤血供。典型中枢神经细胞瘤可见“椒盐征”(血管流空信号)。
CT检查:对钙化灶(如少突胶质细胞瘤)和急性出血(如海绵状血管瘤破裂)显示更清晰,可作为急诊评估手段。
PET-CT:用于鉴别肿瘤良恶性,高级别肿瘤常表现为FDG高摄取,而囊肿或低级别肿瘤摄取较低。
(3)病理确诊方法
立体定向活检:适用于深部或体积较小的病变,活检阳性率达95%以上(《Neurosurgical Focus》2022),并发症发生率<2%;
手术切除活检:对于较大肿瘤或需同时解除压迫者,可在手术中获取标本,快速冰冻病理指导术式选择。
治疗策略:个体化医学的实践
(1)手术治疗的适应症与术式选择
手术指征:出现症状性脑积水、肿瘤体积>2cm、进行性神经功能恶化或病理提示恶性潜能者需手术。
经典术式:
经额角入路:最常用,通过额部颅骨钻孔或开颅,经额中回或纵裂到达侧脑室前角,适用于大部分占位性病变;
神经内镜辅助手术:创伤小,视野清晰,尤其适合囊肿或小体积肿瘤(<3cm),术后并发症较传统开颅降低30%(《Journal of Neurosurgical Techniques》2023对比研究)。
(2)非手术治疗手段
放射治疗:
-适用于高级别肿瘤术后、无法全切的低级别肿瘤(如间变性室管膜瘤术后需局部放疗,剂量54-60Gy);
-立体定向放射外科(如伽马刀)可用于直径<3cm的残留病灶,单次剂量12-15Gy。
化学治疗:
-少突胶质细胞瘤推荐PCV方案(甲基苄肼+洛莫司汀+长春新碱);
-胶质母细胞瘤需同步替莫唑胺放化疗,6周期辅助化疗。
(3)脑积水的管理
临时性措施:脑室外引流,适用于急性梗阻性脑积水抢救;
永久性措施:脑室-腹腔分流术,约15%-20%的患者术后需调整分流管(《Neurosurgery Focus》2021并发症统计)。
预后与长期管理
(1)不同病理类型的预后差异
良性病变:室管膜下囊肿、低级别星形细胞瘤手术全切后10年生存率超95%,复发率<5%;
恶性肿瘤:胶质母细胞瘤中位生存期14.6个月,5年生存率仅5%-10%(参考SEER数据库2022统计);
特殊类型:中枢神经细胞瘤经规范治疗后5年无进展生存率达78%,优于多数脑室内肿瘤。
(2)术后随访方案
影像学随访:术后3个月首次复查MRI,此后每6个月1次,持续5年;
神经功能评估:包括认知量表(如MMSE)、运动功能测试(如肌力分级),早期发现复发或后遗症。
(3)并发症防治
颅内感染:术后发生率约2%-5%,需严格无菌操作,必要时使用抗生素预防;
缄默症:罕见但严重的并发症,与损伤前额叶内侧结构相关,发生率约0.5%-1%,康复治疗可改善预后。
预防与早期筛查建议
(1)先天性病变的预防
-孕期避免接触致畸因素(如放射线、有毒化学物质),孕20-24周胎儿MRI可筛查部分先天性脑室病变;
-遗传性疾病(如神经纤维瘤病1型)患者需定期头颅MRI检查,早发现早干预。
(2)高危人群筛查策略
-有家族性脑瘤病史者,建议从20岁起每2-3年行头颅MRI检查;
-出现不明原因头痛、呕吐或肢体乏力者,及时神经科就诊,避免漏诊。
常见问题答疑
1.侧脑室前角病变一定需要手术吗?
不一定。无症状的室管膜下囊肿、直径<1cm的非肿瘤性病变可定期观察;若出现脑积水、神经功能缺损或肿瘤恶变倾向,则需手术。
2.手术会影响记忆力吗?
可能存在短期记忆影响,与前额叶操作相关。但现代显微手术技术已显著降低该风险,约90%患者术后3-6个月记忆功能可恢复至术前水平。
3.儿童患者术后需要特殊康复吗?
是的。儿童术后应尽早介入神经康复,包括认知训练、肢体功能锻炼,必要时联合教育康复,降低发育落后风险。
4.病变复发的信号有哪些?
常见复发信号包括头痛加重、肢体无力反复出现、视力下降等,出现上述症状需及时复查影像学。
5.放化疗对侧脑室前角病变的效果如何?
对敏感性肿瘤(如少突胶质细胞瘤、中枢神经细胞瘤)效果显著,可降低复发率;高级别肿瘤需联合放化疗改善生存期,但无法根治。
侧脑室前角原发病变的诊疗需兼顾解剖复杂性与病理多样性,从“是否严重”的疑问到“如何管理”的实践,医学正通过精准诊断、个体化治疗和全程管理提升患者预后。对于患者而言,科学认知病变性质、配合规范随访,是实现长期健康管理的关键。随着神经外科技术与分子医学的发展,未来该领域的诊疗必将迈向更精准、更微创的新高度。
- 文章标题:侧脑室前角原发病变是什么?严重吗?
- 更新时间:2025-05-27 14:20:48

 400-029-0925
400-029-0925