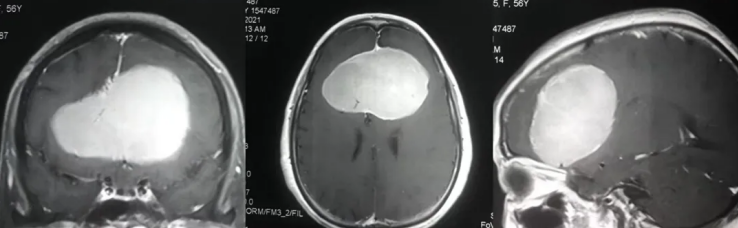
大脑作为人体的“司令部”,其每一处细微病变都可能引发复杂的临床症状。在颅脑影像学检查中,“大脑镰旁钙化灶”“巨大占位病变”“脑膜瘤占位病变”是常见的报告术语,这些名词往往让患者心生疑虑:钙化灶是否会恶变?巨大占位意味着肿瘤晚期吗?脑膜瘤是否必须手术?
大脑镰旁钙化灶会病变吗?
(一)钙化灶的形成机制与常见类型
大脑镰旁钙化灶是指发生在大脑镰(分隔左右大脑半球的结缔组织隔膜)及其附近区域的钙盐沉积现象。从影像学表现看,这类钙化多呈斑点状、斑片状或条索状高密度影,其形成机制主要与以下因素相关:
1.生理性钙化:约30%-40%的正常成年人在头颅CT检查中可发现大脑镰钙化,多见于50岁以上人群,与年龄增长导致的结缔组织退变、血管壁硬化有关,属于无临床意义的良性改变<sup>[1]</sup>。
2.病理性钙化:
感染后遗症:如脑囊虫病、结核性脑膜炎愈合后,病灶内可遗留钙化;
代谢性疾病:甲状旁腺功能减退、假性甲状旁腺功能减退等疾病可引起颅内多发钙化;
肿瘤相关性钙化:少部分脑肿瘤(如脑膜瘤、少突胶质细胞瘤)可因肿瘤细胞分泌钙磷代谢因子或坏死组织机化而出现钙化。
(二)钙化灶的病变风险分层
临床实践中,判断钙化灶是否具有恶变潜力,需综合以下维度评估:
1.钙化形态与分布特征
良性特征:生理性钙化多表现为双侧对称、边缘光滑的斑点状钙化,直径通常<1cm,无周围组织水肿;
警示信号:若钙化灶呈不规则团块状,伴周边低密度水肿带,或短期内体积明显增大,需警惕肿瘤性钙化的可能。
2.伴随临床症状
生理性钙化一般无明显症状,而病理性钙化若压迫邻近神经结构,可出现头痛、癫痫发作、肢体乏力等表现。一项纳入1200例大脑镰旁钙化患者的回顾性研究显示,伴有癫痫发作的患者中,17.3%经病理证实为肿瘤性钙化<sup>[2]</sup>。
3.动态随访观察
对于首次发现的钙化灶,建议每6-12个月复查头颅CT或MRI。若钙化灶在2年内体积增大超过20%,或出现新的影像学异常(如强化效应),需进一步行PET-CT或穿刺活检明确性质。
(三)钙化灶的临床处理原则
生理性钙化:无需特殊治疗,定期影像学随访即可;
感染后钙化:若病灶稳定且无症状,可临床观察;如合并癫痫发作,需抗癫痫药物治疗;
肿瘤性钙化:一旦确诊为恶性肿瘤(如间变性脑膜瘤),需尽早手术切除,术后根据病理结果辅以放疗或化疗。
延展阅读:钙化灶与脑血管病的关联
近年研究发现,大脑镰旁钙化可能与脑小血管病存在潜在联系。一项发表于《Neurology》的研究指出,大脑镰钙化患者发生脑白质病变的风险较无钙化者高1.8倍,其机制可能与钙化导致的局部血流动力学改变有关<sup>[3]</sup>。这一发现为钙化灶的临床意义提供了新的研究方向。
大脑镰旁巨大占位病变
(一)占位病变的影像学界定与临床意义
大脑镰旁巨大占位病变是指发生在大脑镰附近,体积≥3cm(或占据单侧脑室1/3以上空间),并对周围脑组织产生明显压迫效应的病变。这类病变的影像学特征包括:
-CT表现为等密度或稍高密度影,可伴钙化或囊变;
-MRI显示T1加权像呈等或低信号,T2加权像呈高或混杂信号,增强扫描多有不同程度强化。
占位效应可导致脑脊液循环受阻,引发颅内压增高(头痛、呕吐、视乳头水肿),或压迫皮层功能区出现局灶性神经缺损症状。
(二)常见病因与病理类型
1.肿瘤性占位
脑膜瘤:占大脑镰旁占位的60%-70%,多为良性,起源于蛛网膜帽状细胞,生长缓慢,血供丰富;
胶质瘤:以星形细胞瘤为主,恶性程度根据WHO分级而异,易浸润周围脑组织;
转移瘤:多见于中老年患者,原发灶以肺癌、乳腺癌、黑色素瘤常见,常为多发占位。
2.非肿瘤性占位
血肿:硬膜下血肿或脑内血肿,多有明确外伤史,急性期CT呈高密度,亚急性期逐渐转为等密度;
囊肿:蛛网膜囊肿或神经上皮囊肿,属于先天性良性病变,少数可因囊液分泌增多而增大;
炎症性病变:脑脓肿或肉芽肿,常伴发热、血常规异常等感染证据。
(三)诊疗流程与决策要点
1.诊断步骤
病史采集:重点询问头痛性质、癫痫发作频率、肢体活动变化等;
影像学检查:头颅MRI(平扫+增强)是首选检查,必要时行MRS(磁共振波谱分析)鉴别肿瘤与非肿瘤病变;
病理确诊:对于疑似恶性肿瘤者,可通过立体定向穿刺或开颅手术活检获取病理标本。
2.治疗策略
手术指征:凡出现颅内压增高症状、神经功能缺损进行性加重,或影像学高度怀疑恶性肿瘤者,均应考虑手术切除。一项关于大脑镰旁巨大占位的手术研究显示,完整切除肿瘤可使患者5年生存率提升至78%,显著高于部分切除或保守治疗组<sup>[4]</sup>。
手术难点:大脑镰旁占位常邻近矢状窦(颅内主要静脉回流通道),术中需警惕大出血风险,对于侵犯矢状窦的肿瘤,需采用显微外科技术分块切除。
辅助治疗:恶性肿瘤术后需联合放疗(如调强放疗)或化疗(如替莫唑胺),降低复发风险。
(四)特殊人群管理:儿童与老年患者
儿童患者:大脑镰旁占位以胶质瘤多见,手术需兼顾肿瘤切除与神经功能保护,对于无法全切的低级别胶质瘤,可采用“观察-等待”策略,待患儿年龄增长后再行二次手术;
老年患者:需综合评估心肺功能及肿瘤恶性程度,对于高龄、体能状态差的脑膜瘤患者,可选择立体定向放射治疗(如伽马刀)替代手术。
大脑镰旁脑膜瘤占位病变
(一)脑膜瘤的生物学特性与临床分型
大脑镰旁脑膜瘤起源于大脑镰附着处的蛛网膜颗粒,占颅内脑膜瘤的15%-20%。根据WHO分级:
I级(良性):占80%-85%,包括脑膜上皮型、纤维型、过渡型等,生长缓慢,全切后复发率<5%;
II级(非典型):占10%-15%,细胞增殖活跃,术后5年复发率约40%;
III级(间变性):占5%-10%,具有恶性肿瘤特征,易远处转移,术后复发率高达70%以上<sup>[5]</sup>。
分子遗传学研究发现,约50%的散发性脑膜瘤存在NF2基因(22号染色体长臂缺失)突变,这一发现为靶向治疗提供了新靶点。
(二)临床表现与早期识别
大脑镰旁脑膜瘤的症状具有隐匿性,早期多无明显不适,随着肿瘤增大可出现:
颅内压增高症状:头痛、呕吐、视力下降,多因肿瘤压迫上矢状窦导致静脉回流障碍;
癫痫发作:以额叶癫痫常见,表现为对侧肢体抽搐或感觉异常;
肢体功能障碍:肿瘤侵犯中央前回时,可出现进行性肢体乏力,多从下肢开始累及上肢。
值得注意的是,约20%的大脑镰旁脑膜瘤患者因肿瘤位于“哑区”(非功能区),直至肿瘤体积巨大时才被发现<sup>[6]</sup>。
(三)手术治疗的技术革新与风险防控
1.手术入路选择
矢状窦旁入路:适用于肿瘤主体位于大脑镰一侧者,术中需暴露矢状窦两侧颅骨;
纵裂入路:通过切开大脑纵裂暴露肿瘤,可减少对正常脑组织的牵拉,适用于双侧生长的肿瘤。
2.关键技术要点
血管控制:大脑镰旁脑膜瘤的血供主要来自脑膜前动脉和大脑前动脉分支,术前可行DSA检查明确供血血管,术中优先处理肿瘤基底血供;
神经保护:利用神经导航和术中电生理监测技术,实时定位运动皮层和语言中枢,避免手术损伤。
3.术后并发症管理
静脉性梗死:术中损伤矢状窦可导致脑静脉回流障碍,术后需密切观察意识状态,及时处理脑水肿;
脑脊液漏:多因硬脑膜缝合不严密所致,需行腰大池引流或二次修补术。
(四)术后随访与复发预防
随访频率:术后前2年每3个月复查头颅MRI,之后每6-12个月复查一次;
复发预测因素:肿瘤残留、WHO分级≥II级、Ki-67增殖指数>10%是复发的独立危险因素;
辅助治疗:对于非典型或间变性脑膜瘤,术后推荐行放疗(剂量54-60Gy),可降低复发风险40%-50%<sup>[7]</sup>。
常见问题答疑
1.大脑镰旁钙化灶需要治疗吗?
多数生理性钙化无需治疗,定期随访即可。若钙化灶伴发癫痫、头痛等症状,或影像学提示肿瘤性钙化,需根据病因采取药物或手术治疗。
2.巨大占位病变是否等于恶性肿瘤?
不一定。巨大占位可为良性病变(如巨大蛛网膜囊肿、慢性硬膜下血肿),也可为恶性肿瘤。确诊需结合影像学特征和病理检查结果。
3.大脑镰旁脑膜瘤手术风险高吗?
手术风险与肿瘤大小、位置及术者经验相关。现代显微神经外科技术已使大脑镰旁脑膜瘤的全切率提升至90%以上,术后严重并发症发生率<5%。
4.脑膜瘤术后多久能恢复正常生活?
良性脑膜瘤患者术后1-3个月可基本恢复正常生活,非典型或恶性脑膜瘤患者需根据术后治疗情况调整康复计划,建议术后6个月内避免重体力劳动。
5.大脑镰旁病变会遗传吗?
多数散发性病变(如生理性钙化、良性脑膜瘤)无遗传性。少数遗传性疾病(如神经纤维瘤病2型)可增加脑膜瘤发病风险,此类患者需定期进行颅脑影像学筛查。
- 文章标题:大脑镰旁钙化灶会病变吗?
- 更新时间:2025-06-04 11:11:09

 400-029-0925
400-029-0925