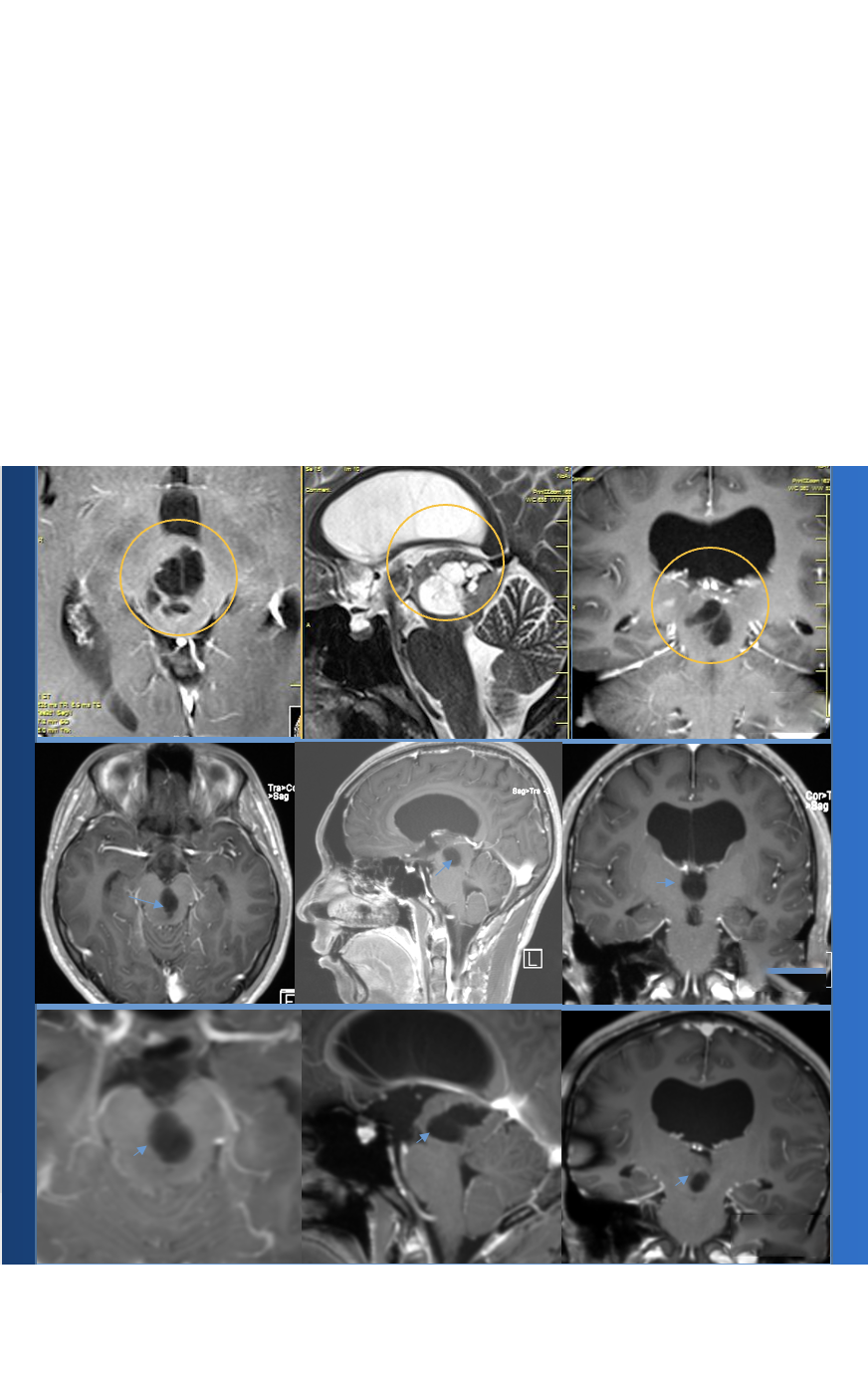
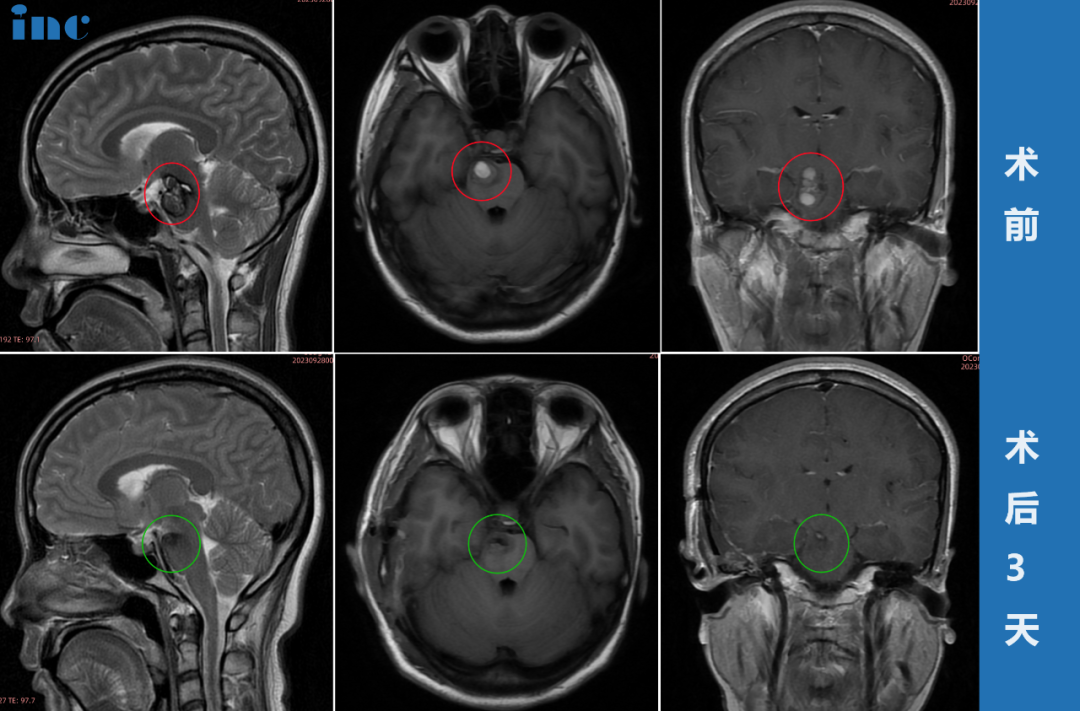
影像报告中“顶叶见不规则低密度影,伴局部颅骨增生”的描述,常指向脑膜瘤诊断。脑膜瘤源于脑膜被覆细胞,多属良性且生长缓慢。顶叶区域掌管感觉整合与空间认知,此处病变可引发头痛、感觉异常或癫痫发作。伴随的颅骨增生是脑膜瘤向外生长的典型影像标志。CT与MRI成像是识别此类病变的核心技术,理解这些术语对把握病情至关重要。
影像特征深度解析
核心征象剖析
不规则低密度影特征
CT图像中“低密度”指该区域X线吸收率低于正常脑组织,呈深灰色调。“不规则”形态表明病灶边界不清,可呈分叶状或毛刺状,提示内部成分混杂(如坏死区或囊变区)。《中华放射学杂志》2025年研究指出,约24.7%脑膜瘤在CT平扫中呈现此特征(样本量287例),非典型性脑膜瘤更常见。
颅骨增生机制解析
此为脑膜瘤特征性伴随征象。肿瘤附着颅骨内板时,持续刺激骨膜成骨细胞,导致局部骨质增厚硬化。中国脑肿瘤登记中心2024年报显示,该征象总体发生率为31.5%,与肿瘤附着位置直接相关。

强化模式与信号特征
对比增强表现
增强扫描是评估关键。90%以上良性脑膜瘤呈现显著均匀强化,源于丰富肿瘤血管网。若内部存在坏死囊变,则强化不均。
脑膜尾征诊断价值
增强MRI可见肿瘤邻近硬脑膜呈线状强化延伸。2023年《Neurosurgery》多中心研究证实,此征象诊断特异性超85%。
多序列信号规律
T1WI:等或稍低信号(对比脑灰质)
T2WI:信号多变(等/高/混杂)
FLAIR:清晰显示瘤周水肿带
病理机制与生物学行为
肿瘤起源与生长模式
脑膜瘤起源于蛛网膜帽状细胞,以膨胀性生长挤压脑组织为主要方式(区别于胶质瘤的浸润性生长)。临床症状多源于占位效应。
颅骨增生形成机制
本质是肿瘤刺激骨膜引发的反应性成骨:
1.物理刺激:肿瘤持续压迫骨膜
2.生化刺激:肿瘤分泌成骨因子
3.细胞激活:成骨细胞功能亢进
4.骨质沉积:新生骨基质累积增厚
鉴别诊断关键要点
顶叶不规则低密度影伴颅骨增生需鉴别:
转移瘤影像特征
密度特征:低/等/混杂密度
骨质改变:溶骨性破坏为主(虫蚀样)
水肿特点:常伴明显指状水肿
强化模式:环状或结节状强化
高级别胶质瘤鉴别要素
密度表现:混杂密度(坏死+出血)
水肿程度:显著不规则水肿
骨质改变:罕见增生
强化特征:不规则厚环状强化
其他需鉴别病变
淋巴瘤:CT平扫多呈等/高密度,均匀强化
脑脓肿:薄壁环形强化,结合感染症状
孤立性纤维瘤:STAT6阳性,易致溶骨破坏
预后评估体系
核心影响因素
WHO分级决定性作用
WHO 1级:10年复发率10-20%(中国共识2024:Simpson I级切除10年PFS>90%)
WHO 2级:5年复发率40-50%(辅助放疗提升5年PFS至60-70%)
WHO 3级:中位生存期<5年
切除程度量化标准
Simpson分级与复发风险呈负相关:
I级:全切肿瘤+受累硬膜/骨
II级:全切肿瘤+电灼硬膜
III级:肿瘤全切未处理硬膜
分子标志物预后价值
TERT启动子突变
CDKN2A/B纯合缺失
BAP1失活
提示高级别脑膜瘤不良预后
长期管理规范
随访监测方案
频率设置
术后/放疗后第1年:每3-6个月MRI
第2-3年:每6-12个月
3年后稳定期:每年1次
WHO 2-3级:缩短随访间隔
评估内容
影像学:原瘤床/残腔复发征象
神经功能:感觉/运动/语言/认知
治疗副反应:放射性坏死等
复发干预原则
根据复发灶特点选择:
二次手术
再程放疗
系统药物治疗
联合治疗
临床疑问精解
Q:CT报告“不规则低密度影”一定是脑膜瘤吗?
A:不一定。需结合强化特征、水肿范围及颅骨改变综合判断。转移瘤、胶质母细胞瘤等均可出现类似表现,最终确诊依赖病理。
Q:无症状顶叶脑膜瘤必须手术吗?
A:非必须。直径<3cm的无症状肿瘤,尤其老年患者,首选定期MRI随访(6-12个月/次)。手术干预仅适用于进展性增大或新发症状者。
Q:术后颅骨增生能消退吗?
A:已增生骨质不会自行复原。手术切除肿瘤后,成骨刺激消除可阻止继续增生。影响美观的增生骨质术中可同步处理。
Q:脑膜瘤会遗传吗?
A:散发性脑膜瘤无遗传性。仅神经纤维瘤病2型(NF2基因突变)患者脑膜瘤发病风险显著增高,具有遗传特性。
- 文章标题:顶叶见不规则低密度影,伴局部颅骨增生,脑膜瘤
- 更新时间:2025-07-07 16:16:22

 400-029-0925
400-029-0925