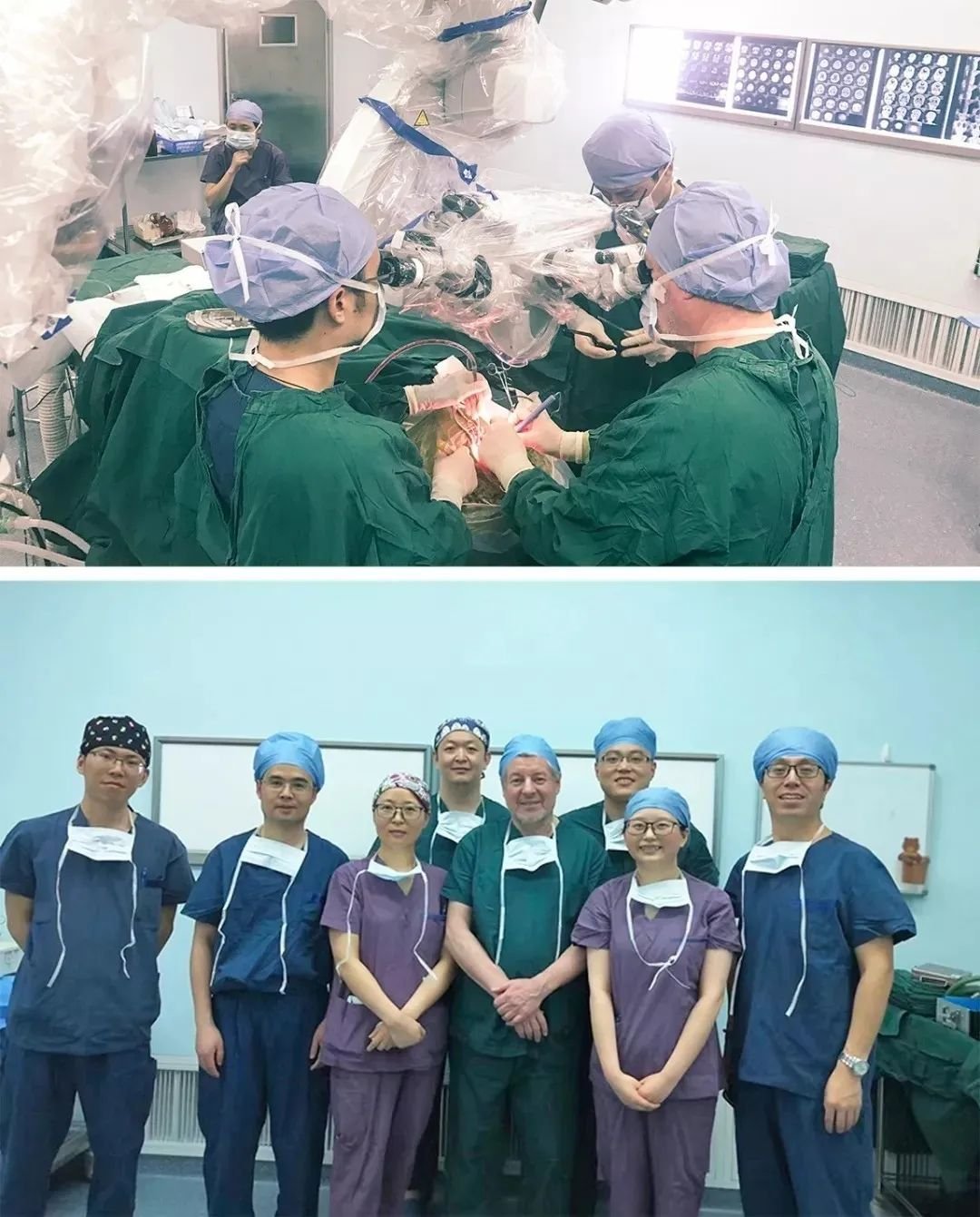
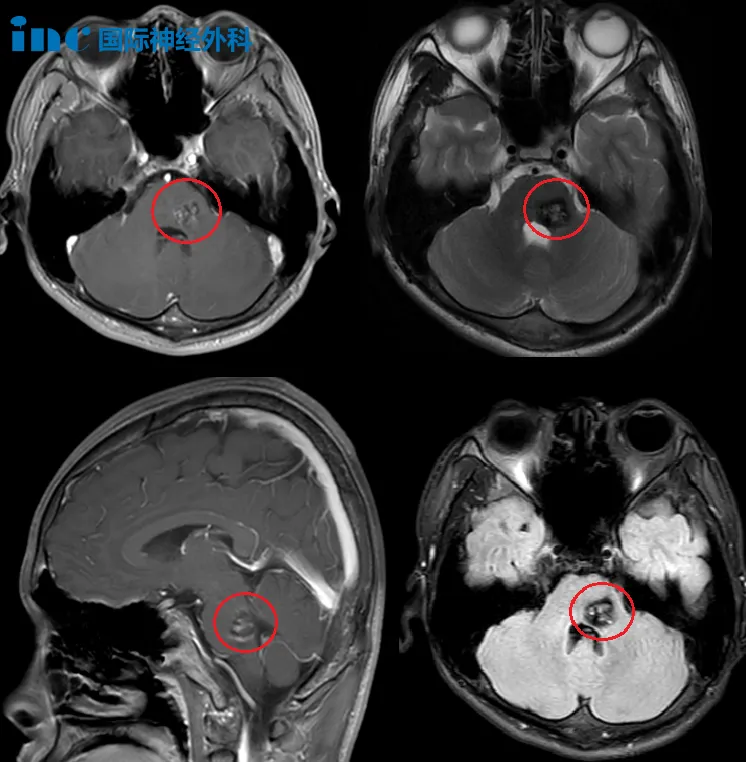
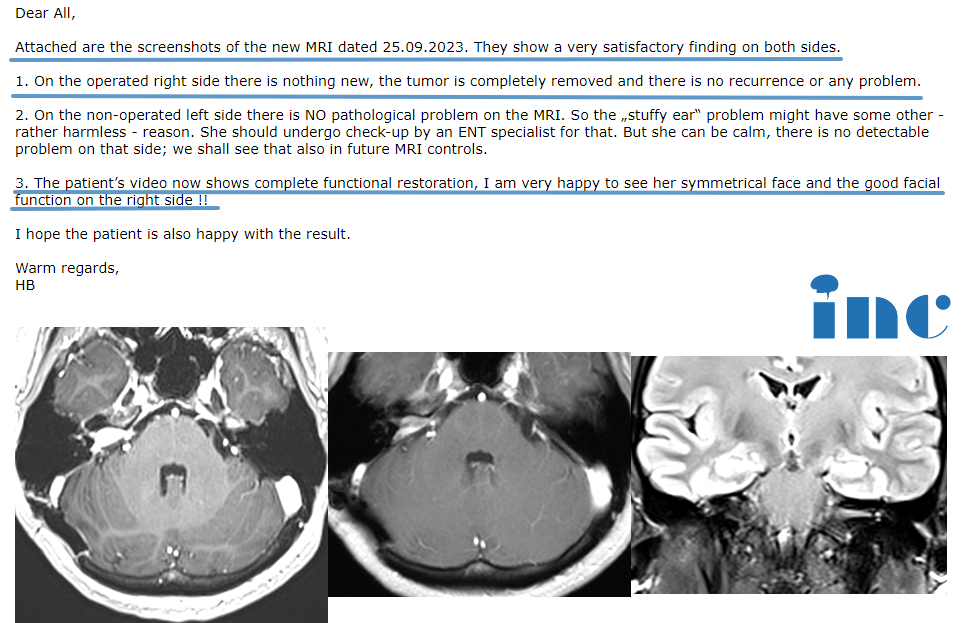
在神经外科临床工作中,影像报告出现"脑干内小片状低密度影,边界清晰"时,常需在腔隙性脑梗死与肿瘤之间做出鉴别。这两种病变虽影像表现有重叠,但病理机制、治疗方案及预后差异显著:前者源于小血管闭塞性缺血,后者为神经胶质细胞异常增殖所致。
病理机制:两种病变的核心差异在哪里?
(一)腔隙性脑梗死的病理演变过程
腔隙性脑梗死的发生与穿支动脉病变密切相关。这类直径100-400μm的细小血管(如基底动脉旁中央支),因长期高血压导致血管壁玻璃样变,或心源性微栓子阻塞,引发局部脑组织缺血坏死[2024年《中国脑血管病防治指南》]。
急性期(1-3天):缺血区细胞水肿,血脑屏障破坏
亚急性期(1-2周):坏死组织被巨噬细胞清除,胶质细胞开始增生
慢性期(1个月后):形成边界清晰的腔隙灶,直径3-15mm,好发于脑桥基底部
(二)脑干肿瘤的组织学特征
脑干肿瘤以星形细胞瘤为主(占70%),其低密度影形成机制包括:
良性肿瘤(如毛细胞型星形细胞瘤):
肿瘤细胞分化良好,生长缓慢,周围脑组织形成反应性胶质增生带,故边界清晰;部分因细胞水肿或囊性变呈现低密度[2023年《中华神经外科杂志》]。
恶性肿瘤(如间变性星形细胞瘤):
肿瘤细胞浸润性生长,边界模糊,低密度区常伴坏死或出血,CT表现为混杂密度影。

影像特征:CT与MRI如何捕捉关键差异?
(一)CT平扫:从密度变化看病变阶段
CT是初步筛查的重要手段,通过密度值(HU)变化可初步区分病变性质:
腔隙性脑梗死:
急性期:边界模糊,密度值20-25HU(水肿导致)
亚急性期:密度降至15-20HU,边界渐清
慢性期:脑脊液样低密度(10-15HU),伴胶质增生带
脑干肿瘤:
良性:均匀低密度(25-30HU),囊性变时可见更低密度区(15-20HU)及等密度囊壁结节
恶性:密度不均,可见出血灶(高密度)或坏死区(<10HU),边界多模糊
(二)MRI多序列成像:细微特征的精准捕捉
MRI凭借高软组织分辨力,在鉴别诊断中发挥关键作用:
1.T1WI序列信号特点
腔隙性脑梗死:均匀低信号,与脑脊液信号接近
脑干肿瘤:良性呈等/稍低信号(信号均匀),恶性可见混杂信号(出血灶呈高信号)
2.T2WI/FLAIR序列水肿表现
脑梗死:慢性期无明显水肿,仅亚急性期可见轻微水肿带
脑干肿瘤:65%患者可见病灶周围水肿(FLAIR高信号环),显著高于脑梗死(12%)[2024年《Neuroradiology》]
3.增强扫描的鉴别价值
这是区分两者的核心手段:
腔隙性脑梗死:多数无强化,仅亚急性期偶见轻度环状强化(新生血管所致)
脑干肿瘤:良性多无强化或轻度斑片状强化,恶性呈不规则显著强化(强化幅度>50%)[2023年NCCN中枢神经系统肿瘤指南]
临床识别:除了影像还有哪些线索?
(一)症状发作模式的差异
特征
腔隙性脑梗死
脑干肿瘤
起病方式
急性发作(数分钟达高峰)
隐匿起病(病程>3个月占40%)
典型症状
纯运动性偏瘫(60%)、构音障碍
交叉性瘫痪、吞咽困难、头痛
颅内压增高
少见
常见(肿瘤占位效应)
(二)高危人群与危险因素
腔隙性脑梗死:
50-70岁中老年群体,80%合并高血压,长期血压控制不佳者(>160/100mmHg)风险增加3倍[2024年《中国高血压防治指南》]。
脑干肿瘤:
儿童以低级别星形细胞瘤为主(占75%),成人多为高级别胶质瘤或转移瘤,家族史(如神经纤维瘤病1型)或既往恶性肿瘤病史者需警惕。
诊断流程:从初步筛查到病理确诊
(一)影像学检查的选择策略
急诊首选CT检查:
目的:快速排除脑出血(高密度影),观察低密度影位置及边界
注意:发病6小时内CT可能阴性,需结合MRI-DWI序列(显示弥散受限高信号)
鉴别诊断核心:MRI增强扫描:
无强化病灶:符合血管分布区(如脑桥基底部),倾向腔隙性脑梗死
结节状/不规则强化:高度怀疑肿瘤,需进一步评估
(二)疑难病例的进阶检查
MRS波谱分析:
脑梗死:N-乙酰天门冬氨酸(NAA)显著降低,胆碱(Cho)水平正常
肿瘤:Cho升高,NAA降低,可见异常脂质峰[2024年《中华神经影像杂志》]
DSA血管造影:
适用:怀疑血管性肿瘤(如血管网织细胞瘤),可显示异常血管团
脑梗死:多无异常,仅少数可见穿支动脉狭窄
病理确诊手段:
神经导航下穿刺活检:诊断准确率95%以上,适用于深部病灶
手术切除活检:获取完整标本,明确肿瘤分级(WHOⅠ-Ⅳ级)[2023年《Neurosurgery》]
治疗策略:因病施治的关键选择
(一)腔隙性脑梗死的分层治疗
1.急性期(发病4.5小时内)
溶栓治疗:符合指征者(NIHSS评分≤25分)静脉注射rt-PA,血管再通率30%-40%[2024年《急性缺血性卒中诊疗指南》]
血压管理:收缩压<220mmHg时暂不降压,避免加重缺血
2.恢复期与二级预防
药物干预:抗血小板聚集(阿司匹林100mg/日),控制血糖(HbA1c<7%)、血脂(LDL-C<1.8mmol/L)
康复治疗:发病24-48小时后启动,针对肢体功能障碍、构音障碍进行个体化训练,3个月内症状缓解率达70%[2023年《中国脑卒中康复治疗指南》]
(二)脑干肿瘤的多模态治疗
1.良性肿瘤(WHOⅠ-Ⅱ级)
手术策略:显微镜下沿肿瘤-脑组织界面切除,全切率60%-70%,术后无需辅助放疗
随访方案:每年1次增强MRI,5年生存率超过90%[2024年《中国脑肿瘤诊疗指南》]
2.恶性肿瘤(WHOⅢ-Ⅳ级)
综合治疗:手术尽可能减瘤后,行同步放化疗(放疗54-60Gy+替莫唑胺75mg/m²/日),中位生存期延长至14.6个月
新兴技术:立体定向放射外科(伽马刀)适用于深部病灶,单次剂量12-15Gy控制肿瘤生长
3.围治疗期管理重点
生命体征监测:脑干手术需警惕呼吸抑制(发生率8%),术后24小时内持续心电监护
吞咽功能评估:45%患者术后出现吞咽障碍,需行洼田饮水试验,严重者留置胃管预防误吸[2024年《中华神经外科疾病研究杂志》]
预后评估:不同病变的转归如何?
(一)腔隙性脑梗死的长期管理
复发风险:1年复发率15%-20%,合并糖尿病者风险加倍,建议每6个月复查头颅CT+颈部血管超声
功能预后:直径<10mm的病灶预后良好,仅5%-10%遗留永久性神经功能缺损;脑桥被盖部病灶可能导致长期共济失调
(二)脑干肿瘤的生存分析
病理分级
5年生存率
复发特点
随访频率
WHOⅠ-Ⅱ级
70%-80%
20%-30%进展为高级别肿瘤
每年增强MRI
WHOⅢ-Ⅳ级
10%-15%
术后2年内复发(强化结节增大)
每3-6个月MRI
常见问题答疑
(一)发现低密度影后,是否需要立即做增强MRI?
答:建议尽快完善。增强扫描是鉴别肿瘤的关键,尤其对于可疑肿瘤病灶,延迟检查可能影响治疗时机。
(二)孕妇做增强MRI安全吗?
答:MRI无辐射,钆剂增强剂在肾功能正常时安全性较高,但需经产科医生评估,优先选择孕期中后段检查。
(三)脑干肿瘤术后出现面瘫,能恢复吗?
答:取决于损伤程度。轻度神经水肿所致面瘫,经激素治疗(泼尼松1mg/kg/日)和康复训练,3-6个月恢复率约60%;神经断裂者需手术修复。
(四)腔隙性脑梗死患者能否接种新冠疫苗?
答:病情稳定期(发病3个月后)且无疫苗过敏史者,可在血压控制达标(<140/90mmHg)后接种,接种后需监测神经功能变化。
(五)影像显示低密度影周围水肿,一定是肿瘤吗?
答:不一定。亚急性脑梗死也可能出现轻度水肿,但肿瘤水肿范围更广(FLAIR序列显示连续高信号环),需结合增强扫描综合判断。
- 文章标题:脑干内见小片状低密度影,边界清晰,考虑腔隙性脑梗死或肿瘤
- 更新时间:2025-07-07 17:48:29

 400-029-0925
400-029-0925