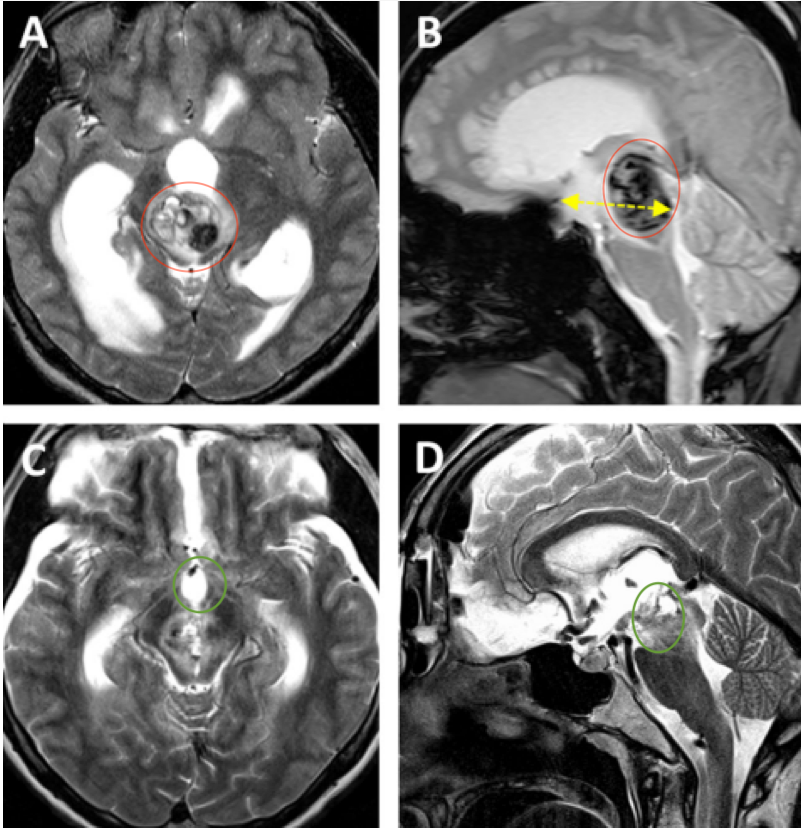
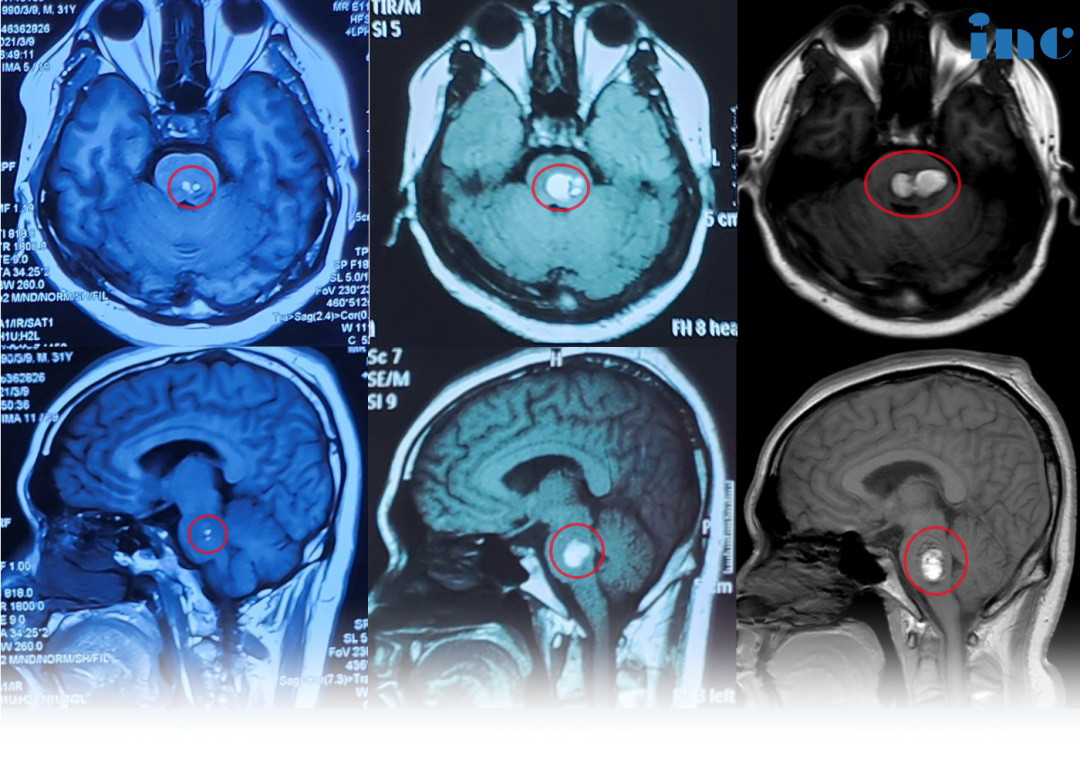
星形胶质细胞瘤与肿瘤性的生长有关吗?星形胶质细胞瘤的肿瘤性生长绝非偶然事件,而是由基因突变、信号通路失控及微环境重塑共同驱动的精密病理过程。作为最常见的颅内原发肿瘤,它占胶质瘤的65%以上,其侵袭性生长模式与分子异常深度绑定。从原癌基因C-sis的过度表达导致PDGF-β链异常增殖,到肿瘤抑制基因P53、Rb的失活解除细胞周期刹车,再到微环境中星形胶质细胞分泌IL-6促进肿瘤迁移——这些机制层层嵌套,构成肿瘤生长的核心引擎。
分子驱动机制:基因突变如何启动失控增殖
肿瘤性生长的根源在于基因组稳定性丧失。研究发现,约83%的星形胶质细胞瘤存在IDH1/2基因突变(异柠檬酸脱氢酶基因突变,影响细胞代谢),导致代谢产物2-羟戊二酸蓄积,进而抑制组蛋白去甲基化酶,引发全基因组甲基化异常。这种"代谢-表观遗传耦合效应"使细胞分化程序崩溃,推动肿瘤早期形成。
核心信号通路失控进一步加速恶性转化:
•PDGF通路持续激活:原癌基因C-sis过度表达促使PDGF-β(血小板衍生生长因子)分泌增加,通过自分泌循环刺激肿瘤细胞增殖,该机制在约45%的II级星形细胞瘤中起主导作用。
•EGFR扩增诱发下游级联:erb-B1扩增导致表皮生长因子受体(EGFR)过表达,持续激活Ras/MAPK通路,驱动细胞周期蛋白D1表达升高,使细胞分裂周期缩短40%。
•抑癌基因失活解除刹车:P53突变使DNA损伤修复失效(发生率>60%),Rb基因缺失导致G1/S期检查点失灵,P16缺失则加速细胞周期进程——三者共同构成"促癌铁三角"。
这些改变最终汇聚于细胞周期引擎失控:CDK4/6激酶活性异常升高,磷酸化Rb蛋白释放E2F转录因子,驱动细胞从G1期强制进入S期,开启不可逆的肿瘤性增殖。

微环境重塑:肿瘤如何"驯化"周围组织
肿瘤微环境(TME)不是被动旁观者,而是被主动改造为生长支持系统。胶质瘤细胞通过分泌外泌体携带miR-21等分子,重编程周围细胞的功能状态:
1.免疫细胞叛变:
•小胶质细胞被诱导为M2型抗炎表型,分泌TGF-β和IL-10抑制T细胞活性,形成免疫豁免区。
•肿瘤相关巨噬细胞(TAMs)通过CD142介导凝血酶生成,激活蛋白酶激活受体(PAR)信号,促进细胞外基质(ECM)重塑,为肿瘤侵袭铺路。
2.血管新生网络构建:
•缺氧诱导因子HIF-1α激活VEGF(血管内皮生长因子)表达,刺激内皮细胞异常增殖,形成结构紊乱的血管网络(血管通透性增加3倍)。
•胶质瘤干细胞(GSCs)分泌PDGF-BB,招募少突胶质前体细胞包裹血管基底膜,加固新生血管结构。
3.细胞外基质癌变改造:
•基质金属蛋白酶MMP-14降解胶原蛋白,开辟侵袭通道;同时上调BEHAB/brevican形成促迁移微环境,使肿瘤细胞移动速度提升50%。
•组织型转谷氨酰胺酶(TGM2)交联纤维蛋白,形成物理屏障阻碍药物渗透,降低化疗敏感性。
恶性演进阶梯:从低级别到高级别的分子跃迁
肿瘤分级本质是基因组不稳定性累积的结果:
WHO II级→III级间变转化
IDH突变型肿瘤中,ATRX基因缺失(发生率70%)导致端粒维持异常,染色体末端融合事件增加;伴随TP53二次突变,细胞获得逃避衰老能力。此时肿瘤增殖指数(Ki-67)从5%跃升至15%,MRI开始显示不均匀强化。
III级→IV级胶母转化
关键转折是TERT启动子突变(胶质母细胞瘤中发生率>80%),重新激活端粒酶延长端粒,赋予细胞永生性。同时出现EGFRvIII截短突变(占GBM的30%),该变异体无需配体即可自发激活,驱动PI3K/AKT通路持续开启,最终导致:
•坏死区形成:缺氧诱导HIF-1α上调BNIP3促凋亡基因,但AKT磷酸化抑制其功能,迫使细胞进入坏死性凋亡。
•血管内皮增生:VEGF过表达诱导内皮细胞多层堆叠,形成"肾小球样"病态血管。
治疗策略革新:靶向生长引擎的精准干预
传统治疗遭遇瓶颈源于对肿瘤生长机制的认知局限,新型策略直击关键靶点:
阻断分子驱动引擎
•IDH抑制剂:艾伏尼布竞争性抑制突变型IDH1酶,降低2-羟戊二酸水平,逆转组蛋白高甲基化状态。III期临床试验显示,用药组中位无进展生存期延长4.1个月。
•EGFR双抗:阿米万他单抗同时结合EGFR和MET受体,克服单靶点耐药。对EGFRvIII阳性患者客观缓解率达37%。
瓦解微环境支持
•血管正常化疗法:贝伐珠单抗联合FGFR抑制剂(如厄达替尼),通过平衡VEGF/VEGFR信号使血管成熟度提升50%,改善化疗药物递送。
•外泌体拦截技术:CD142靶向纳米颗粒捕获促癌外泌体,使TAMs重编程率下降62%,延缓基质重塑进程。
表观遗传再编程
组蛋白去乙酰化酶抑制剂(HDACi)如伏立诺他,通过开放染色质恢复抑癌基因表达。联合替莫唑胺可使MGMT甲基化患者生存期延长至28.1个月。
常见问题答疑
Q1:什么是“肿瘤性生长”?与普通肿瘤生长有何不同?
肿瘤性生长特指基因驱动+微环境共谋的恶性增殖模式。不同于局部膨胀性生长,它表现为沿白质纤维束浸润(如侵犯胼胝体至对侧半球),且能重塑血管、免疫系统支持自身扩张。
Q2:IDH突变为何能延缓肿瘤生长?
IDH突变通过产生2-羟戊二酸抑制DNA去甲基化酶,导致超甲基化表型——这种状态反而抑制了致癌基因的转录活跃度,使II级肿瘤进展速度比野生型慢2倍呢。
Q3:儿童毛细胞型星形细胞瘤(I级)为何很少恶变?
关键在其BRAF融合驱动而非IDH突变。BRAF-KIAA1549融合激酶持续激活MAPK通路,但受负反馈调节限制;且微环境缺乏促转化因子(如TGF-β),故90%患儿术后20年无进展。
Q4:如何通过生活方式降低复发风险?
需双管齐下:
①代谢干预:生酮饮食(脂肪:蛋白+碳水=4:1)降低血糖波动,抑制IGF-1通路激活;
②抗氧化支持:补充EGCG(绿茶提取物)中和肿瘤源性活性氧,减轻DNA损伤。
Q5:电场治疗(TTF)如何干扰肿瘤生长?
通过低强度交变电场破坏微管蛋白极性,阻断有丝分裂纺锤体形成。对分裂期细胞,可使染色体分离错误率提升5倍,诱导凋亡。
- 文章标题:星形胶质细胞瘤与肿瘤性的生长有关吗?
- 更新时间:2025-08-25 15:10:07

 400-029-0925
400-029-0925