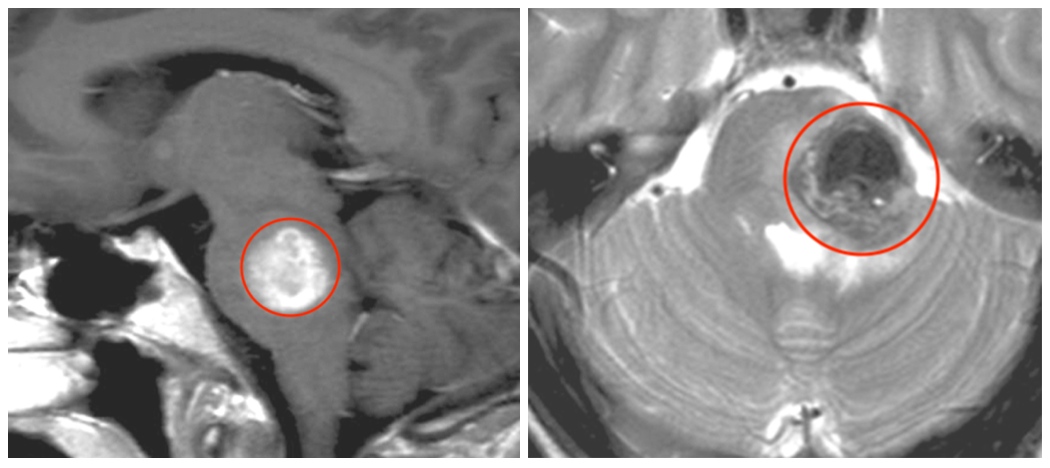
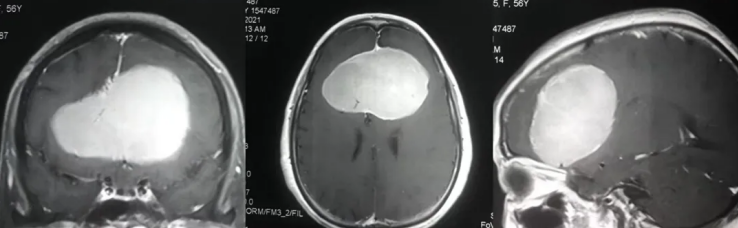
一份影像报告上那句“顶叶可见多发小片状低密度影,部分融合,考虑转移瘤可能?”如同一道悬而未解的谜题,牵动着无数患者与家属的心弦。这短短一行字背后,是大脑深处悄然发生的复杂病变过程,是精密影像技术与临床医学思维的激烈碰撞,更是后续诊断方向的重要指引。影像学描述不仅传递着潜在的疾病信号,更揭示了人体内正在上演的微观世界剧变。
在医学影像的世界里,每一个术语都承载着特定的病理意义。“顶叶多发小片状低密度影,部分融合” 这一描述,在CT图像上勾勒出一幅值得高度警惕的图景。这些低密度区域并非孤立存在,它们的分布特点、融合倾向强烈指向一种可能性——肿瘤的转移性播种。我们将深入剖析这一影像描述背后的解剖、病理、临床与诊疗逻辑,带您走进医学影像解读的思维核心。
一、 解码术语:影像描述的科学内涵
解剖定位 - “顶叶”:
顶叶位于大脑半球的中上部,中央沟之后,枕叶之前。它是大脑皮质的重要组成部分。
关键功能区:初级躯体感觉皮层(接收和处理身体对侧的感觉信息,如触觉、痛觉、温度觉、本体感觉)、感觉联合皮层(整合感觉信息,形成对物体形状、质地等的认知)、涉及部分语言功能(特别是优势半球的角回)、空间定向和计算能力。
临床意义:发生在顶叶的病变,可能引起对侧肢体的感觉障碍(麻木、感觉丧失、感觉异常)、实体觉丧失(无法通过触摸识别物体)、失用症(执行熟练动作的能力丧失)、Gerstmann综合征(优势半球病变:手指失认、左右失定向、失写、失算)、空间忽视(非优势半球病变)等。
影像特征 - “多发小片状低密度影”:
“低密度影”:在CT(计算机断层扫描) 图像上,不同组织对X射线的吸收程度不同,表现为不同的灰度(密度)。水、脑脊液、水肿、坏死组织、脂肪等对X射线吸收少,呈黑色或暗灰色,称为“低密度”。正常脑实质呈中等灰色(灰质比白质稍亮)。肿瘤组织、新鲜出血、钙化等对X射线吸收多,呈白色或亮灰色,称为“高密度”。
“多发”:指病灶数量不止一个,散在分布。这通常是转移性病变的典型特征,但也见于感染(如多发脑脓肿)、炎症(如多发脱髓鞘斑块)、血管性病变(如多发梗塞)等。
“小片状”:描述了病灶的形态(片状)和相对大小(较小)。这与较大的块状占位(如原发脑肿瘤)形成对比。
病变进展特征 - “部分融合”:
指多个原本独立的小病灶之间界限变得模糊不清,相互连接融合成更大、形态更不规则的病灶。
病理学意义:这强烈提示病变具有侵袭性和活动性进展。多个病灶融合,通常意味着病灶在局部扩展、浸润,破坏了正常的脑组织边界。
诊断倾向性:融合现象是支持“转移瘤”诊断的一个重要影像学特征。转移灶生长迅速,瘤周水肿明显且常相互融合,容易呈现这种表现。其他如活动性的炎症或感染灶(如播散性脑炎、某些真菌感染)也可能出现融合。
影像诊断提示 - “考虑转移瘤可能”:
这是影像科医生基于上述影像特征(多发、小片状、低密度、融合),结合解剖位置和常见病规律,给出的初步诊断倾向性意见。
“考虑...可能” 是影像报告中常见的谨慎表述,表明这是可能性最大的诊断,但并非最终确诊,需要结合临床和其他检查进一步验证。
核心逻辑:脑实质内多发病灶,特别是位于皮髓质交界区(血供丰富,转移瘤好发部位),具有活动性(融合提示进展),在成人患者中,转移瘤是首要考虑。因为脑转移瘤的发生率远高于原发恶性脑肿瘤(如胶质母细胞瘤),且原发脑肿瘤通常表现为单发肿块(尽管高级别胶质瘤如胶质母细胞瘤也可呈多灶性,但相对少见)。

二、 核心病理:为何“转移瘤”成为首要怀疑对象?
转移瘤的生物学本质:
转移是指恶性肿瘤细胞从原发部位(如肺、乳腺、肾脏、胃肠道、皮肤等)脱落,通过血液循环(最常见)、淋巴系统或直接侵犯等途径,播散到身体其他部位(此处为脑组织),并在那里定植、生长形成新的肿瘤病灶。
脑是恶性肿瘤常见的转移部位之一,仅次于肺和肝。
影像特征的高度契合性:
多发性:恶性肿瘤细胞通过血行播散进入脑内,常常是一次性或分批次地播散到多个不同部位,形成多个独立的“种子”病灶,这是转移瘤最突出的特点。
好发部位:转移瘤最常位于大脑中动脉供血区的皮髓质交界处。该区域血管管径突然变细,瘤栓容易在此滞留形成转移灶。顶叶正位于此区域。
生长迅速与瘤周水肿:转移瘤通常生长较快,常引起显著的血管源性脑水肿。水肿液聚集在细胞外间隙,在CT上表现为低密度区。多个转移灶周围的脑水肿常常相互融合,使得病灶本身看起来也“融合”在一起,形成大片低密度区。
低密度:转移瘤灶本身以及其周围的大片水肿在CT上均表现为低密度。虽然某些转移瘤(如黑色素瘤、绒癌、部分肾癌转移)或出血性转移在CT上可呈稍高密度或混合密度,但典型的转移灶及其水肿带表现为低密度非常常见。
融合倾向:快速生长的多发病灶及严重的水肿,极易导致多个病灶在影像学上界限不清,呈现融合状态。
流行病学依据:
在已知有恶性肿瘤病史的成人患者中,如果出现神经系统症状或例行检查发现脑内多发病灶,转移瘤是最常见的原因。
即使没有已知的癌症病史,成人首次发现脑内多发病灶,转移瘤的可能性也远高于多灶性原发脑肿瘤(如多形性胶质母细胞瘤有时可呈多灶)或其他良性病变。
三、 严谨鉴别:并非只有转移瘤这一种可能
尽管转移瘤是首要考虑,但严谨的医学思维要求必须进行鉴别诊断,避免“一叶障目”:
感染性疾病:
脑脓肿(多发):细菌、真菌感染可形成脓肿。早期脑炎阶段CT可表现为边界不清的低密度区;脓肿形成期可见环形强化的脓肿壁(需增强CT或MRI),中心为脓液(低密度),周围有水肿。部分脓肿可融合。通常伴有发热、白细胞升高等感染症状。
脑炎:病毒性或自身免疫性脑炎可导致脑实质弥漫性或局灶性炎症、水肿,CT上可表现为片状低密度影,有时可为多灶。临床表现(发热、意识障碍、精神行为异常、癫痫等)和实验室检查(脑脊液)是关键鉴别点。进行性多灶性脑白质病(PML)是一种由JC病毒引起的罕见脱髓鞘病,多见于免疫抑制患者,CT可表现为多灶白质低密度。
炎症/脱髓鞘疾病:
多发性硬化(MS):典型病灶位于脑室周围白质、胼胝体、脑干、小脑和脊髓。急性期病灶因水肿和炎症可在CT上表现为低密度,但CT对MS病灶显示远不如MRI敏感和特异。MS病灶多为卵圆形,垂直于侧脑室(Dawson手指征),强化模式有特点(开环、均匀)。临床表现(空间和时间多发)是核心。
急性播散性脑脊髓炎(ADEM):常发生于感染或疫苗接种后,为单相病程。病灶可多发、较大,可累及灰质和白质,CT呈低密度。儿童和青少年多见。
神经结节病:一种累及多系统的肉芽肿性疾病,可侵犯脑膜和脑实质。颅内病灶可为多发的强化结节或片状强化病灶,伴或不伴水肿。
血管性疾病:
多发脑梗死:不同时期、不同血管流域的多发脑梗死灶在CT上均可表现为低密度。但梗死灶的分布通常符合特定脑血管供血区,形态(楔形)和演变过程(从模糊到清晰)有其特点。急性期可伴轻微水肿,但融合成大片者相对少见。结合患者脑血管病危险因素和起病方式(常急性发作)鉴别。
脑淀粉样血管病相关炎症(CAA-ri):一种与β-淀粉样蛋白在脑血管沉积相关的炎症性疾病。影像可表现为多灶或融合的皮质下白质低密度(水肿)伴或不伴微出血(MRI SWI/GRE序列敏感)。老年患者多见。
血管炎:原发中枢神经系统血管炎或其他系统性疾病(如系统性红斑狼疮)继发的血管炎,可导致多灶性脑缺血或梗死,表现为低密度区。诊断困难,常需血管造影和脑活检。
其他肿瘤性疾病:
多灶性/多中心性原发恶性脑肿瘤:如多灶性胶质母细胞瘤、原发性中枢神经系统淋巴瘤(PCNSL)。PCNSL在免疫正常患者中常靠近脑室或脑表面,CT平扫可为稍高或等密度,增强后明显均匀强化,瘤周水肿可很显著;在免疫抑制患者中表现可更不典型(如环形强化)。淋巴瘤可多发。
脑膜癌病:肿瘤细胞弥漫浸润软脑膜,可沿血管周围间隙(Virchow-Robin间隙)侵入脑实质浅层,在CT上可表现为脑沟回模糊、脑表面或室管膜下细线状/结节状强化(需增强),也可引起邻近脑实质水肿呈低密度,有时可表现为多灶或较弥漫的皮质/皮质下低密度。
寄生虫感染:如脑囊虫病,可表现为脑实质内多发小囊泡或结节,伴或不伴水肿钙化,不同时期表现复杂。
四、 明确诊断:从影像疑云到病理真相
面对“考虑转移瘤可能”的影像提示,确诊需要一套系统化的临床路径:
详尽的病史与体格检查:
现病史:仔细询问神经系统症状(头痛、恶心呕吐、癫痫、肢体无力麻木、言语障碍、视力视野改变、步态不稳、认知下降等)的性质、严重程度、起病方式和进展速度。
既往史:重中之重是排查恶性肿瘤病史。了解既往是否诊断过癌症、类型、分期、治疗情况(手术、放化疗、靶向、免疫治疗)及时间。询问其他系统性疾病史(感染、自身免疫病、血液病等)。
体格检查:全面的神经系统查体,寻找局灶性体征(运动、感觉、反射、共济、颅神经等)。全身查体寻找可能的原发肿瘤线索(如淋巴结肿大、乳腺包块、皮肤痣、腹部包块等)。
核心影像学复查与升级 - 增强MRI:
金标准地位:对于可疑脑转移瘤或其他颅内病变,颅脑增强MRI(磁共振成像)是首选的进一步影像检查,其软组织分辨率远高于CT,能更清晰显示病灶的数量、大小、位置、形态、信号特点、水肿范围,最重要的是强化方式。
关键信息获取:
T1加权像:转移瘤本身常呈低或等信号,周围水肿呈明显低信号。
T2加权像/FLAIR像:转移瘤信号多变(等、高或混杂),周围水肿呈明显高信号。FLAIR抑制脑脊液信号,对显示近脑室/脑表病灶更佳。
T1增强扫描(使用钆对比剂):这是诊断的关键。转移瘤绝大多数(>95%)会呈现强化,强化模式多样:结节状均匀强化、环形强化(中心坏死常见)、不均匀强化。强化能清晰显示CT上难以发现的小病灶。有助于区分肿瘤实质与水肿。
DWI(弥散加权成像):有助于鉴别脓肿(脓腔弥散受限呈高信号)与肿瘤坏死(通常不受限或轻度受限)。
SWI/GRE(磁敏感加权成像/梯度回波):对检测病灶内出血(常见于黑色素瘤、肾癌、绒癌、甲状腺癌转移)或钙化非常敏感。
特殊序列:如MRS(磁共振波谱)可能提供代谢信息(如高胆碱峰提示细胞增殖活跃),但临床应用有限。
寻找原发灶 - 全身评估:
全身PET-CT(氟代脱氧葡萄糖,FDG-PET/CT):是目前寻找恶性肿瘤原发灶和评估全身转移范围的最有效手段之一。恶性肿瘤细胞通常高代谢葡萄糖,在PET上表现为异常放射性浓聚。对于影像提示脑转移但原发灶不明的患者意义重大。
胸部/腹部/盆腔CT增强:重点筛查肺癌(脑转移最常见来源)、乳腺癌、肾癌、消化道肿瘤等。
乳腺钼靶/超声(女性)。
肿瘤标志物检测:根据临床怀疑选择(如CEA、CA15-3、CA125、CA19-9、AFP、PSA等),辅助判断原发灶来源,但特异性有限,不能单独用于诊断。
皮肤、淋巴结检查:必要时活检。
最终确诊的基石 - 组织病理学检查:
核心地位:无论影像学多么提示转移瘤,最终确诊的金标准仍然是取得病变组织进行显微镜下的病理检查(包括常规HE染色、特殊染色和免疫组化)。免疫组化对于确定肿瘤的组织来源(原发部位)至关重要。
获取途径:
脑部病灶活检:通过神经导航或立体定向技术精准穿刺获取脑内病灶组织。适用于:原发灶不明;怀疑非转移性病变(如淋巴瘤、感染);原发灶已知但颅内病灶性质不典型或有多种原发癌病史需明确来源指导治疗。
原发灶活检:如果通过全身评估发现了高度可疑的原发肿瘤,优先对原发灶进行活检/切除,病理确诊原发癌的同时,结合典型的颅内多发病灶影像,通常可临床诊断脑转移。
转移灶(非脑部)活检:如果存在更易获取的颅外转移灶(如淋巴结、皮下结节、肝肺转移灶),可对这些病灶进行活检,病理结果同样可指导全身治疗。
必要的辅助检查:
腰椎穿刺与脑脊液检查:当高度怀疑脑膜癌病、感染(尤其是真菌、结核)或淋巴瘤时非常重要。检测脑脊液压力、常规(细胞计数分类)、生化(蛋白、糖)、细胞学(找肿瘤细胞)、病原学检测(涂片、培养、PCR)、肿瘤标志物、流式细胞术等。
血液检查:血常规、肝肾功能、电解质、凝血功能、感染指标(CRP、PCT)、自身免疫抗体谱等,评估全身状况及鉴别诊断。
五、 应对策略:确诊后的多维度治疗与管理
一旦确诊为脑转移瘤,治疗方案高度个体化,需多学科团队(MDT:神经外科、肿瘤科/放疗科、神经内科、影像科、病理科、姑息治疗科等)共同决策,核心考量因素包括:
患者整体状况(Performance Status):卡氏评分(KPS)或ECOG评分是评估患者耐受治疗能力和预后的关键指标。
神经系统症状严重程度:是否存在严重颅高压、神经功能缺损。
颅内转移灶情况:数量、大小、位置(是否位于功能区、深部)、是否引起明显占位效应/脑疝风险、是否活动性出血。
颅外疾病负荷:原发灶控制情况、是否存在其他重要脏器转移及其严重程度。
原发肿瘤类型、分子分型及系统治疗敏感性:这是制定全身治疗方案的基础(如肺癌EGFR/ALK突变、乳腺癌HER2状态、黑色素瘤BRAF突变等)。
既往治疗史:是否接受过放疗、化疗、靶向、免疫治疗及其效果。
核心治疗手段:
对症支持治疗:
控制颅高压和脑水肿:糖皮质激素(如地塞米松)是基石,能快速有效减轻血管源性脑水肿,改善症状。需注意副作用(高血糖、感染、肌病、精神症状、消化道溃疡等)。渗透性脱水剂(甘露醇、高渗盐水)用于急性严重颅高压或脑疝风险时。
抗癫痫治疗:对有癫痫发作或位于易致痫区(如皮层)的转移灶患者,需预防性或治疗性使用抗癫痫药物(AEDs)。
镇痛、止吐、营养支持等。
局部治疗:
神经外科手术:
适应证:占位效应显著、引起颅高压或神经功能损害;病灶数目少(通常1-3个,尤其当是主要责任病灶时);病灶位置表浅可及;原发灶不明需获取组织诊断;预期生存期较长;对放疗不敏感的肿瘤(如肾癌、黑色素瘤部分亚型);顽固性癫痫需手术控制;减压需要。
目标:最大程度安全切除(Maximal Safe Resection)以减轻占位效应、明确病理诊断、改善症状、延长生存。
放射治疗:
全脑放疗(WBRT):传统上用于多发(>4个)脑转移患者的标准治疗。能有效控制颅内病灶、预防新发转移。但主要缺点是可能引起远期神经认知功能下降(如记忆力减退、执行功能下降)。现代技术(如海马保护WBRT)和药物(美金刚胺)可部分减轻此副作用。
立体定向放射外科(SRS):采用高度聚焦的大剂量射线(伽玛刀、射波刀、X刀)精确摧毁靶病灶(通常直径<3cm),对周围正常脑组织损伤小。适用于:转移灶数量有限(1-4个,部分指南扩展至5-10个甚至更多,需个体化评估);手术难以达到或拒绝手术;WBRT后局部复发或进展。优势是认知毒性显著低于WBRT。对数目较多的患者,SRS有时可与WBRT联合(但需权衡认知毒性)。
分次立体定向放疗(FSRT):对较大病灶(>3cm)或邻近关键结构(如视神经、脑干)的病灶,将总剂量分割成多次给予,提高安全性。
全身性抗肿瘤治疗:
重要性日益提升:尤其对于驱动基因突变阳性肿瘤(如EGFR突变/ALK融合NSCLC、HER2阳性乳腺癌)或对免疫检查点抑制剂敏感的肿瘤(如黑色素瘤、MSI-H/dMMR肿瘤、部分NSCLC)。
穿透血脑屏障(BBB)能力:是选择药物的重要考量。小分子靶向药物(如奥希替尼、阿来替尼、拉罗替尼、恩曲替尼等)和某些化疗药(如替莫唑胺)具有一定穿透BBB的能力。大分子药物(如单抗)穿透能力通常较差。免疫检查点抑制剂(PD-1/PD-L1抗体)虽然自身难以大量进入正常BBB,但能激活外周免疫细胞,且当BBB被转移灶破坏后,也可能在颅内发挥效应。
应用场景:
作为一线治疗:对于无症状或症状轻微的多发脑转移,且原发肿瘤对系统治疗高度敏感(如EGFR突变肺癌用奥希替尼、ALK融合肺癌用阿来替尼、HER2阳性乳腺癌用图卡替尼+曲妥珠单抗+卡培他滨等),可优先尝试全身治疗,密切监测颅内反应。有效则可推迟或避免局部治疗(尤其是WBRT),保护认知功能。
与局部治疗联合:全身治疗联合SRS或手术,可提高局部控制率和全身疾病控制率。
局部治疗失败后的挽救治疗。
个体化治疗模式选择示例:
寡转移(1-4个):
有症状/大病灶/占位效应明显:手术切除主要病灶 + SRS处理残留/小病灶 ± 全身治疗。或 SRS ± 全身治疗。
无症状/小病灶:SRS ± 全身治疗 或 全身治疗(尤其敏感肿瘤)优先。
多发转移(>4个):
无症状或症状轻,全身治疗高度敏感:全身治疗优先,密切随访。
症状明显/广泛水肿:WBRT(考虑海马保护+美金刚胺) ± 全身治疗。
病灶数量较多但总体负荷不太重(如5-15个小病灶):SRS(尤其是体积小、位置分散)也是一种选择(需高级别中心评估),或 SRS + 全身治疗。WBRT仍是重要选项。
脑膜转移:治疗棘手,常采用全脑全脊髓放疗(WCBRT)、鞘内化疗(甲氨蝶呤、阿糖胞苷)以及高剂量穿透BBB的全身治疗(如奥希替尼治疗EGFR突变NSCLC的脑膜转移)。
预后与随访:
脑转移瘤预后整体较差,但个体差异巨大。影响因素包括:原发肿瘤类型及分子特征(如乳腺癌、肺癌EGFR/ALK阳性预后相对好于黑色素瘤、小细胞肺癌)、颅外疾病控制情况、KPS评分、年龄、脑转移灶数量及大小、是否累及关键部位、治疗反应等。
随着精准靶向治疗和免疫治疗的发展,部分类型脑转移患者生存期已显著延长(可达数年)。
定期随访至关重要:通常包括神经系统评估和影像学复查(增强MRI)。随访频率根据病情、治疗方案和稳定性调整。目的是监测治疗反应、早期发现复发或新发病灶、评估副作用并及时干预。
- 文章标题:顶叶可见多发小片状低密度影,部分融合,考虑转移瘤可能
- 更新时间:2025-06-26 02:48:42

 400-029-0925
400-029-0925