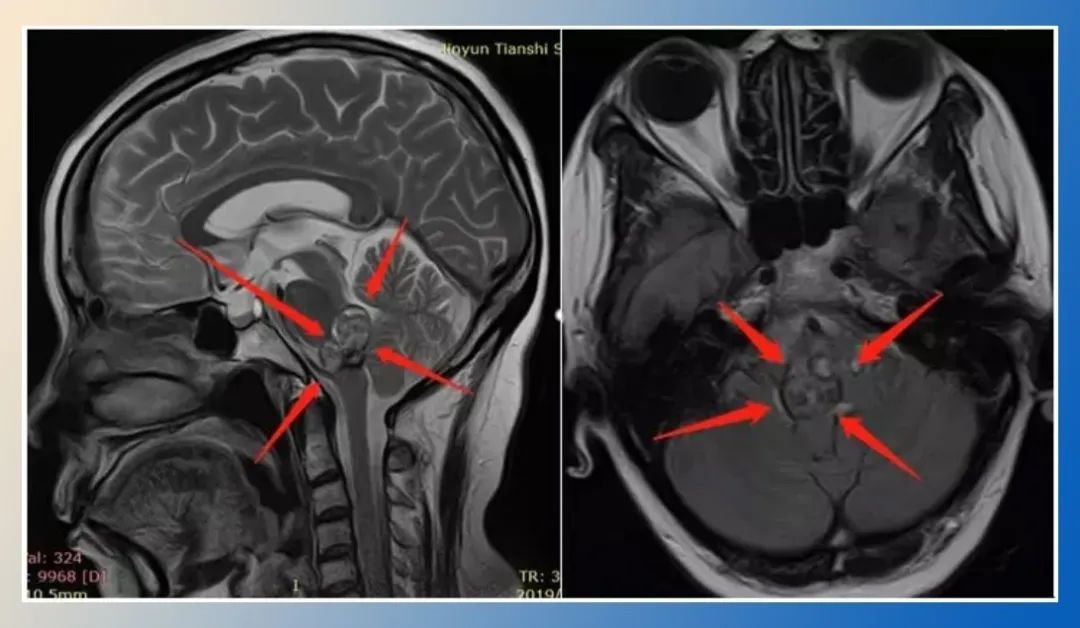
经常有患者拿着影像学报告询问:“右侧桥臂及小脑半球占位是什么意思?”这类涉及后颅窝区域的病变往往让普通人感到陌生,却与平衡功能、肢体协调等日常生活密切相关。下面小编将从疾病本质、诱因、临床表现、诊疗方案到术后管理进行全景式解读,帮助患者及家属建立系统化认知,从容应对诊疗过程中的困惑。
右侧桥臂及小脑半球占位是什么病
“占位”是医学影像学的专业术语,指颅内出现异常组织占据原有神经结构的空间。右侧桥臂及小脑半球占位特指病变位于小脑半球与脑桥连接的右侧区域,这里集中了小脑的运动协调中枢、脑桥的神经传导纤维以及丰富的血管网络。
从解剖位置看,桥臂(小脑中脚)是连接小脑与脑桥的纤维束,负责传递大脑皮层与小脑之间的运动指令;小脑半球则主导躯体平衡、肌肉张力调节和运动轨迹规划。当此处出现占位性病变,可能是原发性脑肿瘤(如星形细胞瘤、血管母细胞瘤)、转移性肿瘤(如肺癌脑转移)、血管性病变(如海绵状血管瘤)或炎症性肉芽肿等。不同性质的病变对神经功能的影响程度差异显著,需通过多模态检查精准鉴别。

引发原因
原发性肿瘤成因
- 遗传因素:约5%-10%的颅内肿瘤与遗传突变相关,如神经纤维瘤病2型患者易发生双侧听神经瘤,可能累及桥小脑角区;结节性硬化症患者小脑半球星形细胞瘤发生率升高(《Neurology》2021年研究)。
- 环境暴露:长期接触电离辐射(如放疗后二次肿瘤)、某些化学致癌物(如氯乙烯、多环芳烃)可能增加发病风险,但目前尚无明确剂量-效应关系。
- 细胞异常增殖:正常神经胶质细胞或血管内皮细胞在基因表达调控失衡时,可能转化为异常增殖的肿瘤细胞,形成占位病灶。
转移性肿瘤机制
约30%的颅内占位为转移性病变,常见原发灶包括肺癌(占脑转移瘤的40%)、乳腺癌(15%)、黑色素瘤(10%)等(美国临床肿瘤学会ASCO数据)。癌细胞通过血液或淋巴循环迁移至桥臂及小脑半球,因该区域血管丰富且血脑屏障相对薄弱,成为转移好发部位。
非肿瘤性病变诱因
- 血管性疾病:海绵状血管瘤是常见的血管畸形,因薄壁血管异常聚集形成占位,可能与先天发育或后天血管内皮损伤有关。
- 感染与炎症:结核杆菌、隐球菌等病原体感染可引发肉芽肿性炎症,在小脑半球形成炎性占位;自身免疫性疾病如神经结节病也可能累及该区域。
症状:从细微征兆到典型表现
平衡与协调功能障碍
最早期症状常表现为步态不稳,患者自觉“脚踩棉花感”,行走时向右侧偏斜,上下楼梯容易踩空。随着占位增大,可出现肢体共济失调,如右手持筷时震颤、系纽扣动作笨拙,这是由于小脑半球对同侧肢体运动控制失效所致。约70%的患者会出现眼球震颤,表现为双眼不自主地水平或旋转性颤动,尤其在凝视侧方时明显。
颅神经压迫症状
桥臂区域毗邻面神经、听神经等后组颅神经,病变可能刺激或压迫神经:
- 听力下降与耳鸣:约30%的患者出现单侧听力进行性减退,类似“耳朵进水”的闷胀感,需与耳科疾病鉴别。
- 面部麻木或疼痛:三叉神经分支受累时,右侧面部可出现针刺样疼痛,或触觉、痛觉减退。
颅内压增高表现
当占位体积超过代偿空间(约20-40ml),会引发头痛、呕吐、视乳头水肿“三联征”:
- 头痛:多为持续性钝痛,晨起或用力时加重,可能伴随后枕部牵涉痛。
- 喷射性呕吐:与进食无关,呕吐后头痛可短暂缓解。
- 视力模糊:视乳头水肿导致视神经传导受阻,严重者可出现视野缺损。
其他特异性表现
- 语言障碍:部分患者出现“爆发性语言”,说话节奏不连贯,类似醉酒者的言语模式。
- 吞咽困难与呛咳:延髓背侧受压时,可能影响吞咽反射,导致饮水呛咳或进食梗阻感。
检查诊断
影像学检查核心手段
1.MRI多序列扫描
T1加权像:区分病变与正常脑组织的解剖边界,肿瘤常表现为低信号或等信号。
T2加权像:显示病变水肿范围,恶性肿瘤周围常伴有大片高信号水肿带。
增强扫描:注射钆对比剂后,恶性肿瘤呈不均匀强化,血管性病变可见异常血管团显影。
2.CT检查
急诊情况下快速判断是否存在出血(高密度影),对钙化灶显示清晰,如脑膜瘤常见斑点状钙化。
3.MRS(磁共振波谱分析)
通过检测病变区代谢物浓度,鉴别肿瘤良恶性:恶性肿瘤胆碱(Cho)峰升高,N-乙酰天门冬氨酸(NAA)峰降低。
神经功能评估
步态测试:让患者单脚站立或走直线,观察是否出现倾倒倾向。
指鼻试验:闭眼后用食指触碰鼻尖,阳性表现为动作笨拙、超过目标(辨距不良)。
眼球运动检查:追踪视靶时观察有无眼震及扫视异常。
病理确诊金标准
立体定向活检:对深在或体积较小的病变,通过神经导航引导获取组织标本,创伤小但取材量有限。
手术切除活检:在开颅手术中完整切除病灶,同时明确病理类型,适用于体积较大、有手术指征的病变。
病理报告需重点关注:细胞分化程度(WHO分级)、增殖指数(Ki-67)、分子标志物(如IDH突变、EGFR扩增),这些信息直接影响治疗方案选择。
治疗
手术治疗:解除占位的核心手段
适应症与术式选择
良性肿瘤(如脑膜瘤、血管母细胞瘤):力争显微镜下全切,术后复发率低。手术入路多采用乙状窦后入路,从耳后切开,经枕骨鳞部磨除骨质,暴露桥小脑角区(图2)。
恶性肿瘤(如胶质母细胞瘤):以减压+活检为主要目的,因肿瘤边界不清,全切率仅30%-50%,需联合术后放化疗。
血管性病变:海绵状血管瘤首选手术切除,减少反复出血风险;动静脉畸形需评估血流动力学,必要时联合血管内栓塞。
术中神经电生理监测
为保护面神经、听神经功能,术中需实时监测:
面神经肌电图:刺激神经分支时记录面部肌肉电活动,避免术中牵拉损伤。
脑干听觉诱发电位:监测听神经传导功能,降低术后耳聋风险。
放疗与化疗:恶性病变的辅助治疗
放疗方案
外照射放疗:采用三维适形放疗(3D-CRT)或调强放疗(IMRT),针对残留肿瘤给予50-60Gy剂量,常规分割25-30次。
立体定向放疗(SRS):如伽马刀、射波刀,适用于直径<3cm的残留病灶,单次高剂量照射,精准保护周围正常组织。
化疗选择
胶质瘤:术后需口服替莫唑胺(TMZ)进行同步放化疗,根据分子病理结果可联合贝伐珠单抗(抗血管生成药物)。
转移瘤:需明确原发灶类型,如肺腺癌脑转移可选用奥希替尼(第三代EGFR-TKI),HER2阳性乳腺癌转移推荐图卡替尼联合曲妥珠单抗。
对症支持治疗
颅内压管理:甘露醇(0.5-1g/kg,q6-8h)联合呋塞米(20-40mg,iv)快速脱水;长期使用地塞米松(2-4mg,q12h)减轻瘤周水肿。
抗癫痫治疗:仅在出现临床发作或脑电图痫样放电时使用,首选左乙拉西坦(起始500mg,bid),避免肝酶诱导剂影响化疗效果。
复发:风险因素与监测策略
复发高危因素
病理分级:WHOⅢ-Ⅳ级恶性肿瘤复发率显著高于Ⅰ-Ⅱ级,胶质母细胞瘤中位复发时间仅6-9个月(《Journal of Neuro-Oncology》2020数据)。
切除程度:次全切除患者复发风险是全切者的2.3倍(Cochrane系统评价),残留病灶成为复发根源。
分子特征:IDH野生型、MGMT启动子未甲基化的胶质瘤更易复发,且侵袭性更强。
复发监测方案
影像学随访:术后3个月首次复查增强MRI,此后每6个月1次,持续5年;若发现病灶增大、强化程度增加,需警惕复发(图3)。
临床症状评估:出现新发头痛、步态不稳或肢体无力时,应及时复查,避免延误诊治。
术后管理:从监护到功能重建
早期重症监护要点
气道管理:术后24小时内密切观察呼吸频率、血氧饱和度,脑干受压患者可能出现中枢性呼吸抑制,需准备气管插管。
体位护理:清醒患者抬高床头30°,降低颅内压;未清醒者取侧卧位,防止呕吐物误吸。
引流管观察:记录脑室引流或术腔引流的颜色、量,若出现血性液体突然增多,提示术后出血可能。
神经功能康复介入
运动功能训练
平衡康复:使用平衡垫、步态训练仪,从站立训练逐步过渡到行走,每日2次,每次30分钟。
肢体协调:通过捏豆子、系鞋带等精细动作练习,改善共济失调,可配合经颅磁刺激(rTMS)增强神经可塑性。
语言与吞咽康复
语言训练:针对爆发性语言患者,进行节奏性说话练习,如跟读绕口令,配合语言治疗师一对一指导。
吞咽管理:呛咳患者需行吞咽造影检查,轻度者改食软食,重度者经鼻胃管喂养,避免误吸性肺炎。
心理社会支持
认知行为疗法(CBT):约40%的患者术后出现焦虑或抑郁,通过正念训练、放松疗法缓解情绪障碍(《Psychooncology》2022研究)。
社会功能重建:鼓励参与病友会,分享康复经验,逐步回归工作岗位,早期可从事轻体力脑力劳动。
预后:生存质量的多因素影响
生存时间预测
良性病变:全切后5年生存率>90%,如小脑半球脑膜瘤患者术后10年无复发生存率达85%(Mayo Clinic数据)。
恶性肿瘤:胶质母细胞瘤中位生存期14-16个月,血管母细胞瘤伴VHL病患者需长期监控其他器官病变。
功能恢复潜力
早期干预关键:术后1-3个月是神经功能恢复黄金期,积极康复治疗可使60%的共济失调患者步行能力显著改善(《Neural Regeneration Research》2023)。
年龄与基础状态:<60岁、术前KPS评分>70分的患者预后更佳,合并糖尿病、高血压者恢复速度较慢。
护理
日常生活护理
饮食管理:术后早期给予高蛋白、高纤维流质饮食(如鸡蛋羹、蔬菜泥),逐步过渡到普食,避免辛辣、过咸食物。每日饮水量控制在1500-2000ml,防止便秘增加颅内压。
安全防护:在卫生间安装扶手,地面铺设防滑垫;行走时建议使用四脚拐,衣裤选择宽松款式,减少跌倒风险。
症状观察与处理
| 异常症状 | 可能原因 | 处理措施 |
| 剧烈头痛伴呕吐 | 颅内压升高 | 立即平卧,抬高床头,口服甘露醇(遵医嘱),急诊就医 |
| 肢体抽搐 | 癫痫发作 | 就地侧卧,取出假牙,记录发作时间,持续>5分钟需静注地西泮 |
| 发热>38.5℃ | 颅内感染或肺炎 | 物理降温,留取血/痰培养,及时应用抗生素 |
用药指导
降压药物:长期服用地塞米松者需监测血糖,可配合胃黏膜保护剂(如奥美拉唑)预防消化道溃疡。
抗癫痫药:不可擅自停药,需定期检测血药浓度(如左乙拉西坦有效浓度12-46μg/ml)。
常见问题
右侧桥臂及小脑半球占位手术风险大吗?
手术风险主要与病变位置和性质相关。该区域毗邻脑干、重要颅神经及血管,手术难度较高,可能出现面瘫、听力下降、吞咽困难等并发症,发生率约10%-15%。但随着神经导航、术中电生理监测技术的普及,全切率提升至70%以上,严重并发症发生率降至5%以下。术前需由神经外科、影像科、麻醉科多学科会诊,制定个体化手术方案,降低风险。
术后多久能恢复正常生活?
恢复时间因人而异。良性肿瘤全切患者,若无严重神经功能损伤,术后2-3个月可基本恢复日常生活,6个月后可从事轻体力工作。恶性肿瘤患者因需辅助放化疗,恢复期延长至6-12个月,且需终身随访。康复期间应遵循“循序渐进”原则,从卧床休息到坐起、站立、行走逐步过渡,配合规范的康复训练,可显著缩短恢复周期。
中医治疗对这类疾病有帮助吗?
中医中药可作为辅助治疗手段,在改善术后乏力、食欲不振、脑水肿等症状方面有一定作用。例如,黄芪、党参等补气中药可增强免疫力;茯苓、白术帮助利水消肿。但需注意,中医治疗不能替代手术、放化疗等核心治疗手段,尤其对于恶性肿瘤,应在西医规范治疗的基础上,联合中医调理,建议选择正规中医院的中西医结合科,避免偏方延误病情。
右侧桥臂及小脑半球占位的诊疗是一个环环相扣的系统工程,从早期识别步态异常、肢体震颤等细微症状,到通过MRI增强扫描、病理活检明确病变性质,再到手术切除联合放化疗的个体化治疗,每一步都需要精准评估与多学科协作。术后康复不仅关注肿瘤控制,更要重视平衡功能重建、心理状态调整,通过早期介入康复治疗,多数患者可显著改善生活质量。对于家属而言,掌握居家护理要点、密切观察症状变化,能为患者提供坚实的支持。
- 文章标题:右侧翘臂及小脑半球占位
- 更新时间:2025-05-08 14:51:18

 400-029-0925
400-029-0925