在中枢神经系统肿瘤的临床诊疗中,髓母细胞瘤始终是极具挑战性的恶性肿瘤之一。作为一种起源于小脑或第四脑室的胚胎性肿瘤,其分子分型的精准判定深刻影响着治疗策略的制定与预后评估。在众多分子标志物中,TP53 基因状态因其对肿瘤生物学行为的显著调控作用,成为临床关注的焦点。本文将围绕 "TP53 野生型髓母细胞瘤能否手术" 及 "术后复发率" 等核心问题,结合最新临床研究与分子生物学证据,从病理机制、手术指征、复发影响因素及全程管理等维度展开系统解析,为患者及临床医师提供科学的决策参考。

一、TP53 基因状态与髓母细胞瘤生物学行为的内在关联
(一)TP53 基因的抑癌机制与肿瘤发生
TP53 基因作为重要的抑癌基因,编码的 p53 蛋白在细胞周期调控、DNA 修复及凋亡诱导中发挥关键作用。正常生理状态下,当细胞遭遇 DNA 损伤时,p53 蛋白被激活,通过阻滞细胞周期或启动凋亡程序维持基因组稳定性。而在髓母细胞瘤发生过程中,TP53 基因的体细胞突变(约 20% 的 SHH 活化型病例)会导致 p53 蛋白功能丧失,引发细胞增殖失控、DNA 损伤修复缺陷及化疗耐药。值得注意的是,TP53 野生型患者因保留完整的抑癌通路,其肿瘤恶性程度相对较低,对常规放化疗的响应性更佳。
(二)TP53 状态在髓母细胞瘤分子分型中的预后价值
根据 2021 年 WHO 中枢神经系统肿瘤分类,髓母细胞瘤分为四大分子亚型,其中 SHH 活化型与 TP53 状态的关联最为密切:约 80% 的 SHH 型患者携带 TP53 野生型基因,多见于 3-16 岁儿童,以促纤维增生型 / 结节型(DIC/N 型)为主,该亚型具有结节状生长、神经元分化及网状纤维沉积等特征,生物学行为相对惰性。临床数据显示,TP53 野生型患者 5 年总生存率(OS)可达 65%-75%,显著高于 TP53 突变型的 30%-40%,这一差异不仅源于基因本身的功能状态,更与下游信号通路调控、肿瘤微环境及治疗敏感性密切相关。

二、TP53 野生型髓母细胞瘤的手术适应性评估
(一)手术在髓母细胞瘤治疗中的核心地位
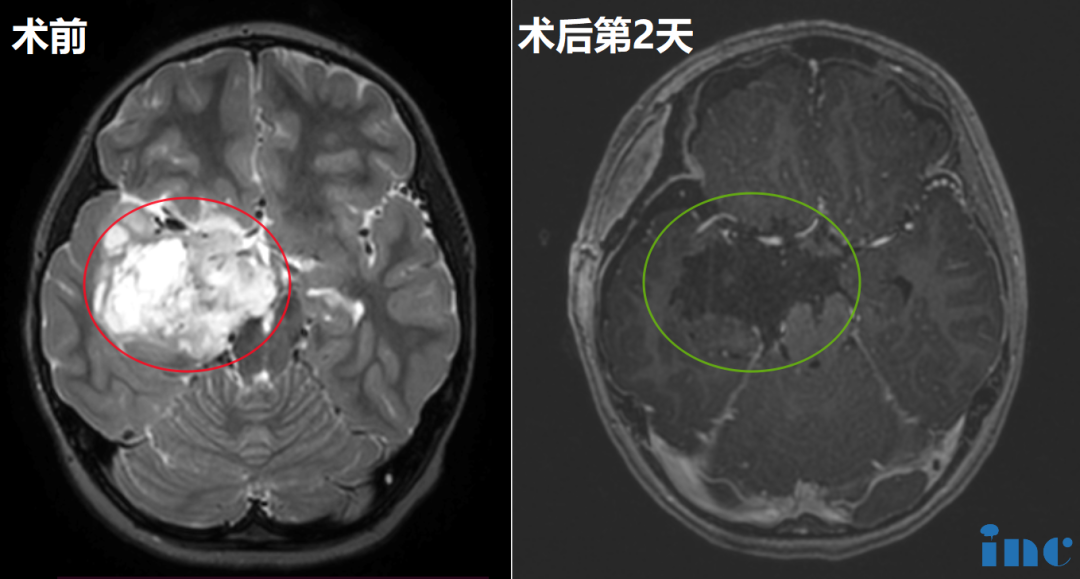
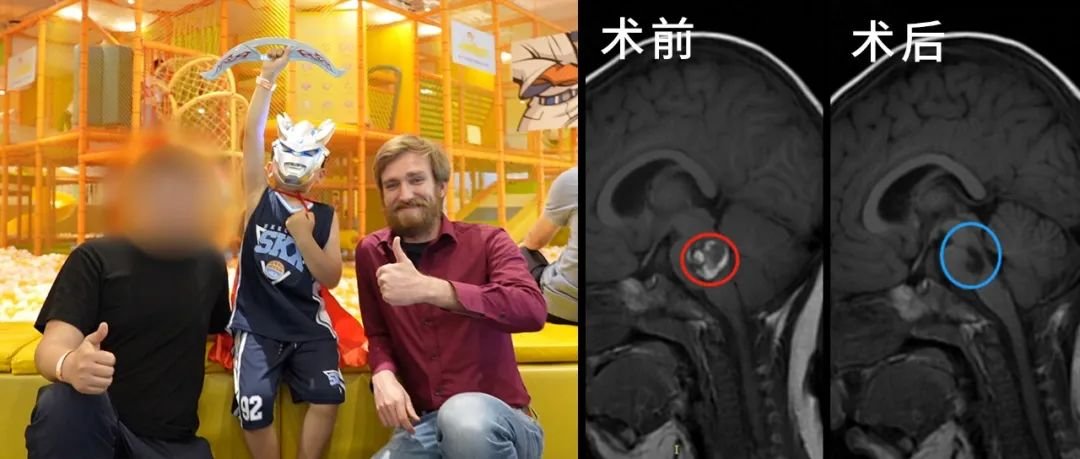
手术切除是髓母细胞瘤综合治疗的首要环节,其目标不仅在于解除肿瘤占位效应,更通过获取完整病理标本为分子分型及后续治疗提供依据。国际儿童肿瘤协作组(COG)研究明确指出,肿瘤全切除(GTR,残留病灶 < 1.5cm²)是改善预后的独立预测因素 ——GTR 患者 5 年无事件生存率(EFS)达 78%,较次全切除(STR)患者的 62% 显著提升(P<0.01)。对于 TP53 野生型患者,尤其是 DIC/N 型儿童病例,完整的手术切除可最大限度降低肿瘤负荷,为后续放化疗创造有利条件。
(二)TP53 野生型患者的手术指征与禁忌症
1. 绝对手术指征
- 肿瘤占位效应:无论肿瘤位于小脑蚓部、半球或第四脑室,若引发梗阻性脑积水、颅高压症状(如头痛、呕吐、视乳头水肿),均需急诊手术解除压迫。
- 组织学确诊需求:对于初诊病例,手术活检或切除是获取病理及分子诊断的唯一途径,尤其需与室管膜瘤、星形细胞瘤等鉴别。
- 局限性肿瘤生长:TP53 野生型肿瘤多呈结节状或分叶状生长,边界相对清晰,为手术全切提供了解剖学基础,尤其是小脑半球的 DIC/N 型肿瘤,全切除率可达 85% 以上。
2. 相对禁忌症
- 广泛脑脊液播散(M3 期):当 MRI 显示脊髓多发转移灶或脑脊液细胞学找到大量肿瘤细胞时,优先考虑术前新辅助化疗缩小转移灶,而非直接手术。
- 严重凝血功能障碍或全身状态不耐受:需通过多学科评估(包括麻醉科、血液科)判断手术风险,对于婴儿患者(<3 岁)需特别关注麻醉时间与脑发育的潜在影响。
(三)现代手术技术对 TP53 野生型患者的价值提升
1. 精准化手术入路选择
根据肿瘤位置采用个体化入路:小脑蚓部肿瘤首选后正中入路,经枕骨大孔暴露第四脑室;小脑半球肿瘤采用旁正中或乙状窦后入路,最大限度保留正常小脑组织。术中神经导航系统可实时定位肿瘤边界,结合荧光造影(如 5-ALA)显影,使显微镜下肿瘤边界识别精度提升 30% 以上。
2. 功能保护技术的应用
电生理监测(包括脑干听觉诱发电位、躯体感觉诱发电位)在手术中持续监测神经功能,尤其在处理与小脑后下动脉(PICA)粘连的肿瘤时,可降低术后小脑性缄默症(发生率 5%-10%)及颅神经损伤风险。对于儿童患者,术中超声引导可动态评估切除程度,避免过度切除导致的神经功能缺损。
3. 分子病理指导的术中决策
快速冷冻切片联合 FISH 技术检测 MYCN 扩增、qPCR 检测 TP53 突变状态,可在 30 分钟内提供分子信息。对于术中确认 TP53 野生型且无 MYCN 扩增的低危患者,可适当调整术后放疗剂量(如低危组全脑脊髓放疗 23.4Gy),而无需过度强化治疗。
三、TP53 野生型髓母细胞瘤术后复发率的多维度分析
(一)复发率的整体数据与亚组差异
根据 SEER 数据库及国际多中心研究,TP53 野生型患者术后 5 年复发率约 30%-40%,显著低于突变型的 60%-70%。但不同亚组存在显著差异:
儿童低危组(M0 期,DIC/N 型,GTR):5 年复发率仅 20%-25%,10 年无复发生存率达 65%-70%,接近良性肿瘤的控制效果。
成人经典型 SHH 患者(无论切除程度):5 年复发率升至 45%-50%,与成人肿瘤细胞增殖活性较高、血脑屏障功能成熟导致药物渗透不足相关。
(二)复发风险的关键影响因素
1. 分子与病理因素
- 组织学类型:DIC/N 型 TP53 野生型肿瘤复发率(25%)显著低于经典型(40%),前者的神经元分化及低 Ki-67 指数(30%-50%)提示较慢的生长速度。
- MYCN 扩增状态:约 10% 的 TP53 野生型患者合并 MYCN 扩增,此类病例复发风险增加 2-3 倍,中位复发时间缩短至术后 18 个月,需警惕早期强化治疗。
2. 临床病理因素
- 手术切除程度:GTR 患者复发率 28%,而 STR 患者升至 45%(P<0.05),残留病灶成为肿瘤复发的根源,尤其在第四脑室等解剖复杂区域,残留肿瘤细胞易逃避放化疗打击。
- 年龄分层:婴儿期(<3 岁)TP53 野生型患者因放疗延迟(需待 3 岁后),单纯化疗期间复发率达 40%-50%,而成人患者因肿瘤细胞对放疗敏感性下降,复发率高于儿童约 15%-20%。
- 转移状态:初诊 M1 期(脑脊液细胞学阳性)患者复发率 42%,显著高于 M0 期的 25%,提示初始分期评估(包括脊髓 MRI 及 CSF 细胞学)的重要性。
3. 治疗相关因素
- 放疗方案合理性:低危组省略全脑脊髓放疗(CSI)会使局部复发率从 15% 升至 30%,而高危组 CSI 剂量不足(如 < 36Gy)导致复发风险增加 20%。质子放疗通过降低正常组织受量,可将儿童患者远期复发率降低 10%-15%。
- 化疗强度与疗程:术后辅助化疗(如 VPC 方案)可使高危组复发率下降 15%,但婴儿患者因化疗耐药性,需在 3 岁后及时启动放疗以巩固疗效。
(三)复发模式与时间分布
TP53 野生型髓母细胞瘤复发以局部复发为主(占 70%),常见于原瘤床及第四脑室周围;脑脊液播散复发约 30%,多表现为脊髓表面结节状转移。复发高峰集中在术后 2-3 年,5 年后复发风险显著降低(年复发率 < 5%)。值得注意的是,携带 SMO 突变的 TP53 野生型患者,复发后对刺猬通路抑制剂响应更佳,中位无进展生存期(PFS)达 6-9 个月,而野生型 SMO 患者复发后靶向治疗效果有限。

四、TP53 野生型髓母细胞瘤的复发预防与全程管理策略
(一)术后早期风险分层与个体化治疗
1. 低危组(M0.GTR,DIC/N 型)
放疗方案:采用 CSI 23.4Gy + 瘤床加量至 54Gy,3 岁以下儿童可延迟至 3 岁后放疗,期间每 4 周 1 次长春新碱单药化疗维持。
随访策略:术后 2 年内每 3 个月颅脑 MRI 增强扫描,同时监测脑脊液 NSE、S100B 等肿瘤标志物,2 年后延长至每 6 个月 1 次,持续 5 年。
2. 高危组(M+,STR,经典型)
强化治疗:术后 2 周内启动大剂量化疗(如顺铂 + 环磷酰胺 + 依托泊苷),联合自体干细胞移植(ASCT),CSI 剂量提升至 36Gy,局部加量至 55.8Gy。
分子监测:通过 ctDNA 检测循环肿瘤 DNA 中的 MYCN 拷贝数变化,可提前 6-12 个月预警复发,灵敏度达 80% 以上。
(二)复发后的综合治疗选择
1. 局部复发的处理
二次手术:对于孤立性局部复发且体能状态良好的患者,首选手术切除,术后挽救性放疗(剂量 50-54Gy)可使 30%-40% 患者获得 5 年生存。
靶向治疗:SMO 突变型复发肿瘤可试用 vismodegib(维莫德吉),客观缓解率约 30%-40%,需注意皮肤毒性(甲沟炎、光敏性皮炎)的管理。
2. 播散性复发的治疗
全脑脊髓再放疗:剂量控制在 30-36Gy,联合替莫唑胺同步化疗,中位生存期约 12-18 个月。
免疫治疗探索:PD-1 抑制剂帕博利珠单抗在复发 SHH 型肿瘤中显示活性,12 周疾病控制率达 55%,尤其适用于 PD-L1 高表达(CPS≥10)的 TP53 野生型患者。
(三)长期生存者的健康管理
1. 神经认知保护
针对接受 CSI 的儿童患者,定期进行智商(IQ)评估与记忆功能测试,早期介入认知康复训练(如注意力训练、海马区功能锻炼),可减缓放疗导致的 IQ 下降(平均下降 10-15 分)。
2. 生长发育监测
每 6 个月检测生长激素、甲状腺功能,40%-50% 的长期生存者需终身生长激素替代治疗;颈椎放疗患者每年进行脊柱 X 线检查,及时发现脊柱侧弯(发生率 20%-30%)。
3. 第二肿瘤预防
放疗后 10 年第二肿瘤累计风险 5%-10%,以脑膜瘤、甲状腺癌为主,建议每年进行全身 MRI 及甲状腺超声筛查,避免长期暴露于辐射环境。
五、TP53野生型髓母细胞瘤常见问题
(一)TP53 野生型髓母细胞瘤是否需要进行基因检测?
是的。明确 TP53 状态是制定精准治疗方案的基础。对于初诊患者,推荐通过二代测序(NGS)检测 TP53 突变、MYCN 扩增、SMO 突变等分子标志物,尤其家族性基底细胞痣综合征(PTCH1 胚系突变)患者,因其 SHH 型髓母细胞瘤风险升高,需终身监测 TP53 状态变化。
(二)术后是否可以选择质子放疗降低复发率?
对于儿童患者,质子放疗在降低正常组织受量的同时,可提高局部控制率。研究显示,质子放疗联合化疗组较光子放疗组,5 年局部复发率从 22% 降至 15%,尤其适用于颞叶、海马区受照射的病例,能显著减少神经认知损伤与第二肿瘤风险。
(三)TP53 野生型患者术后生育能力会受影响吗?
盆腔放疗(仅全脊髓放疗时极少涉及)或烷化剂化疗(如环磷酰胺)可能损伤性腺功能。建议青春期前患者冻存卵巢组织或精子,成年患者治疗前进行生育力评估,必要时采用促性腺激素释放激素类似物保护卵巢功能。
(四)如何区分术后瘢痕与肿瘤复发?
MRI 增强扫描是主要鉴别手段。复发肿瘤多表现为结节状强化灶,DWI 序列呈高信号,ADC 值降低;而术后瘢痕为片状非结节性强化,随时间逐渐减弱。PET-CT(如 18F-FDG)可辅助鉴别,复发肿瘤代谢活性显著高于瘢痕组织。
(五)TP53 野生型患者是否需要预防性使用靶向药物?
目前靶向药物(如 vismodegib)尚未进入一线治疗指南,主要用于复发 / 难治性病例。对于 3 岁以下无法接受放疗的 SMO 突变型 TP53 野生型婴儿,可考虑新辅助靶向治疗缩小肿瘤,为后续低剂量放疗创造条件,但需密切监测药物毒性。
结语
TP53 野生型髓母细胞瘤的诊疗充分体现了精准医学的核心理念 —— 通过基因状态解析指导治疗决策,在追求肿瘤控制的同时优化生存质量。尽管作为 WHO IV 级肿瘤,其术后复发风险仍需警惕,但凭借现代神经外科技术的进步、风险分层治疗的完善及靶向药物的发展,该亚型患者的预后已显著改善。临床实践中,需建立涵盖神经外科、肿瘤放疗科、儿科、分子病理科的多学科协作模式,从手术规划到长期随访进行全程管理,使更多患者在获得长期生存的同时,保持良好的神经功能与生活状态。随着免疫治疗、基因治疗等新技术的深入研究,TP53 野生型髓母细胞瘤的治疗将迎来从 "疾病控制" 到 "精准治愈" 的历史性跨越。
- 文章标题:TP53野生型髓母细胞瘤能手术吗?术后复发率高吗?
- 更新时间:2025-06-05 19:14:07

 400-029-0925
400-029-0925