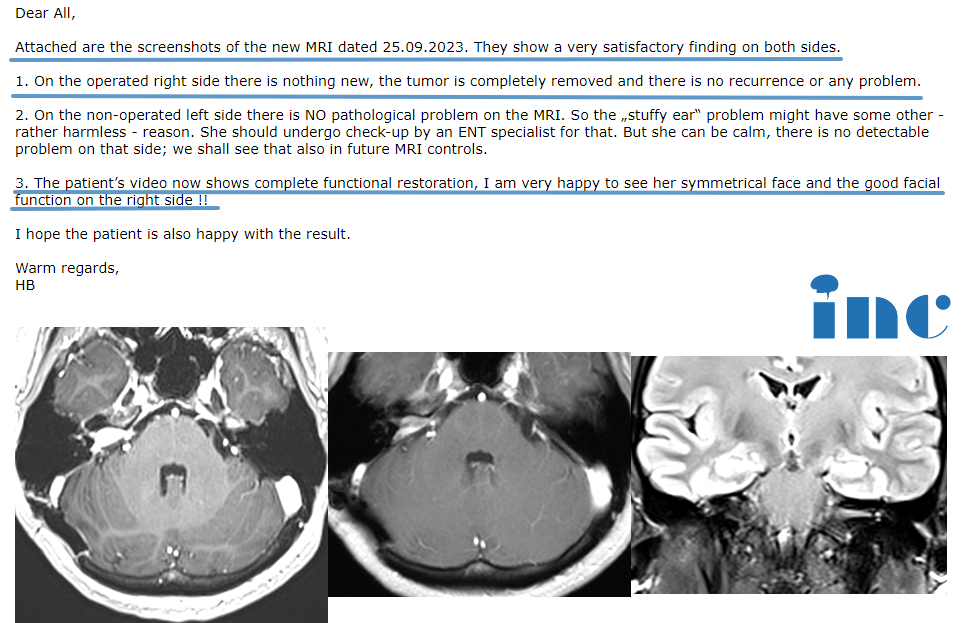
胶质母细胞瘤(GBM)作为最具侵袭性的原发性脑肿瘤,传统治疗手段效果有限。近年来,肿瘤电场治疗、分子靶向药物和免疫治疗策略的突破性进展,正为这一“癌王”带来新的治疗曙光。2025年发表在《Nature Medicine》上的突破性研究报道:一位56岁新诊断GBM患者接受术前三联免疫检查点抑制剂(抗PD-1、抗CTLA-4和抗LAG3)治疗后,肿瘤组织内CD8+T细胞数量激增8倍,术后17个月仍无复发迹象。这一案例揭示了新辅助治疗策略在重塑肿瘤免疫微环境中的关键价值。
1肿瘤电场治疗的临床应用新进展
肿瘤电场治疗(TTFields)通过中频低强度交变电场(100-500kHz)干扰肿瘤细胞有丝分裂,成为GBM治疗的重要物理手段。其便携式设备设计使患者可居家治疗,通过头皮贴片持续发挥抗肿瘤作用,为长期治疗管理提供了独特优势。
1.1临床证据与疗效分析
多项研究证实了TTFields的临床价值:
•EF-14研究:新诊断GBM患者同步放化疗后,TTFields联合替莫唑胺(TMZ)组较单用TMZ组中位无进展生存期(PFS)显著延长(6.7个月vs.4.0个月),中位总生存期(OS)提升至20.9个月(对照组16.0个月)
•真实世界研究:中国数据显示联合治疗组PFS达16个月(对照组11个月),OS达21.8个月(对照组15个月)
•复发GBM治疗:EF-11研究证实TTFields单药治疗仍可带来生存获益
1.2创新联合策略探索
2-THE-TOP研究将TTFields与免疫治疗结合:
•治疗方案:同步放化疗后采用TTFields+帕博利珠单抗+TMZ维持治疗
•疗效对比:PFS达12.0个月(历史对照组5.8个月),OS达24.8个月(历史对照组14.7个月)
•安全性:未显著增加不良事件,耐受性良好
1.3治疗优化与临床管理
关键使用策略包括:
•治疗时长:EF-14研究中患者平均每日使用达18.6小时
•持续治疗:首次进展后继续使用联合化疗可延长OS至11.8个月(对照组9.2个月)
•终止时机:建议至第二次疾病进展后考虑停用
2分子靶向治疗的精准突破
随着肿瘤分子分型的发展,针对特定基因变异的靶向药物为GBM治疗开辟了新路径。2024年,中国国家药监局批准伯瑞替尼用于治疗具有PTPRZ1-MET融合基因的IDH突变型GBM,标志着该领域进入精准治疗新时代。
2.1融合基因靶向治疗
胶质瘤中关键致癌融合基因及其靶向策略:
•MET融合基因
- 发生率:儿童GBM约10%,成人继发性GBM约15%
- 靶向药物:克唑替尼、伯瑞替尼
- 临床数据:伯瑞替尼单药治疗中位OS达6.31个月(对照组3.38个月),死亡风险降低48%
•FGFR-TACC融合基因
- 发生率:IDH野生型Ⅱ/Ⅲ级胶质瘤3.5%,GBM约2.9%
- 靶向药物:FGFR抑制剂
- 病例报告:复发GBM患者治疗显示初步疗效
•EGFR融合基因
- 类型:EGFR-SEPT14(3.7%)、EGFR-PSPH(1.9%)
- 机制:激活STAT3信号通路,增强对EGFR抑制剂敏感性
2.2信号通路抑制剂进展
关键信号通路及其靶向治疗:
•MAPK通路
- BRAF-V600E突变:儿童低级别胶质瘤15-20%
- 靶向方案:达拉非尼联合曲美替尼
- 临床效果:儿童患者ORR达47%(化疗组11%),PFS延长至20.1个月(化疗组7.4个月)
- 成人数据:高级别胶质瘤ORR达33%,中位OS达17.6个月
•RTK-PI3K通路
- 多激酶抑制剂:瑞戈非尼
- 临床验证:Ⅱ期研究显示较CCNU显著延长复发GBM生存期
2.3 IDH抑制剂治疗突破
IDH突变在胶质瘤中的靶向策略:
•作用机制:抑制突变IDH1/2蛋白,减少致癌代谢物2-HG产生
•艾伏尼布研究
非强化组:疾病稳定率85.7%,中位PFS达13.6个月
强化组:疾病稳定率45.2%,中位PFS为1.4个月
•Vorasidenib突破
IN-DIGO研究:IDH突变2级胶质瘤中位PFS达27.7个月(对照组11.1个月)
治疗优势:显著延长至下次干预时间
3免疫治疗的多维度探索
胶质母细胞瘤的“冷肿瘤”特性源于其高度免疫抑制微环境,以髓源性抑制细胞(MDSCs)、M2型巨噬细胞和耗竭T细胞为主要特征。山东大学李刚/薛皓团队最新研究发现:间充质亚型肿瘤细胞(MES-GBM)与SPP1+髓源性巨噬细胞在低氧区域形成免疫抑制生态位,通过circSDHAF2/ITGA5轴介导T细胞耗竭,成为免疫治疗耐药的关键机制。
3.1免疫检查点抑制剂新策略
临床研究进展与创新方案:
•单药治疗困境
- CheckMate-143:Nivolumab较贝伐单抗未显生存优势
- CheckMate-548/498:新诊断GBM联合标准治疗未达终点
•新辅助突破
- 三联方案:抗PD-1+抗CTLA-4+抗LAG3术前应用
- 免疫激活:CD8+T细胞增加8倍,T细胞受体多样性提升
- 生存获益:17个月无复发
•联合增效
- 2-THE-TOP方案:TTFields+帕博利珠单抗+TMZ显著延长PFS和OS
3.2肿瘤疫苗进展
主要疫苗类型及临床效果:
•多肽疫苗
- Rindopepimut:靶向EGFRvIII
- ReACT研究:复发GBM联合贝伐单抗组OS较单药组显著延长
•树突细胞疫苗
- DCVax-L:Ⅲ期研究显示新诊断GBM中位OS达22.4个月
- 复发患者:中位OS达13.2个月,显著优于历史对照
•新抗原疫苗
- 个体化策略:NeoVax联合免疫检查点抑制剂研究进行中
3.3溶瘤病毒创新应用
主要病毒载体及临床进展:
•PVSRIPO
- 作用机制:重组脊髓灰质炎病毒
- 临床数据:2年生存率显著高于对照组
•G47∆
- 日本批准:首个GBM溶瘤病毒疗法
- 疗效数据:19例患者1年生存率84.2%,中位OS达20.2个月
•新型载体
- DNX-2401:联合PD-1抑制剂研究显示47%患者临床获益
- CAN-3110:在部分难治患者中展现潜力
3.4 CAR-T细胞治疗突破
胶质母细胞瘤CAR-T研究进展:
•靶点创新
IL13Rα2/EphA2/HER2:早期临床试验显示有限获益
EGFRvIII:存在抗原逃逸问题
•新型CAR构建
CARv3-TEAM-E:同时靶向EGFRvIII并分泌抗野生型EGFR抗体
临床效果:3例患者均出现快速肿瘤消退
•评估技术革新
类器官模型:利用患者来源GBO实时评估CAR-T疗效
预测价值:体外细胞溶解程度与体内CAR-T扩增相关
4总结与展望
胶质母细胞瘤的治疗已从单一模式向多维度联合策略转变。肿瘤电场治疗作为物理治疗手段,与TMZ联合确立为一线标准方案;分子靶向药物如伯瑞替尼对PTPRZ1-MET融合基因患者的显著疗效,标志精准医疗时代的来临;免疫治疗虽然多数临床试验结果有限,但新辅助策略和联合方案展现出突破潜力。
未来发展方向聚焦三大关键领域:
•耐药机制解析:
深入探索山东大学团队发现的circSDHAF2/ITGA5轴在免疫微环境重塑中的作用,开发针对该通路的小分子抑制剂或单克隆抗体
•治疗时机优化:
推广术前新辅助治疗窗口期的应用,利用手术切除的肿瘤组织进行实时药物敏感性检测,指导术后辅助方案
•创新联合策略:
设计电场+靶向+免疫的三重联合方案,如TTFields与IDH抑制剂序贯应用,或溶瘤病毒与逻辑门控CAR-T的协同治疗
随着2025年克利夫兰医学中心提出的“巨噬细胞-肿瘤细胞双阻断策略”进入临床验证,以及个体化类器官药敏检测平台的建立,胶质母细胞瘤治疗正迈向精准化、个体化的新时代。这些创新策略不仅有望突破生存瓶颈,更将为这一致命疾病带来根本性治疗变革。
- 文章标题:胶质母细胞瘤新型辅助治疗策略:从电场治疗到精准免疫
- 更新时间:2025-07-10 16:51:50

 400-029-0925
400-029-0925