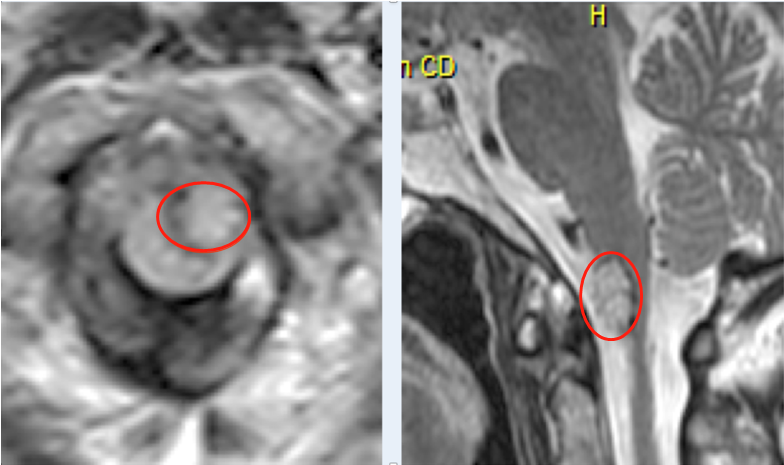
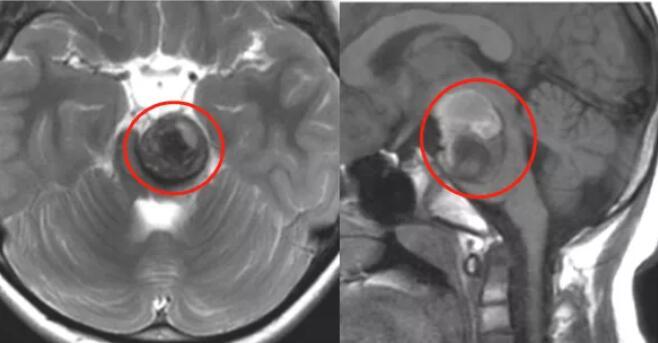
1.IDH突变:异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)是三羧酸循环中的一种关键性限速酶,催化异柠檬酸氧化脱羧生成α-酮戊二酸及CO2,为细胞新陈代谢提供能量和生物合成的前体物质。IDH基因家族有三种异构酶(IDH1,IDH2和IDH3)。IDH1和IDH2的突变在原发性GBM中发生率很低(5.0%),但是在继发性GBM(84.6%)和WHOII级、III级[胶质瘤星形细胞瘤(83.3%)、少突胶质细胞瘤(80.4%)、少突-星形细胞瘤(全切)、间变性星形细胞瘤(69.2%)、间变性少突-星形细胞瘤(86.1%)]中发生率很高。
IDH1/IDH2突变发生在胶质瘤形成的早期,随后根据星形细胞或少突胶质细胞的谱系分化不同可以分别伴随TP53基因突变或1p/19q杂合性缺失。在继发性GBM和低级别弥漫性胶质瘤中,IDH1/IDH2基因突变与TP53突变、染色体1p/19q杂合性缺失及O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)启动子区甲基化状态呈正相关;在原发性GBM中,IDH1基因的突变与10号染色体缺失和EGFR扩增呈负相关。IDH1/IDH2突变与较长的无进展生存期有关,通常发生在年轻成年人和青少年弥漫性胶质瘤患者中。超过90%的IDH基因突变为IDH1突变(均为R132型),其余的为IDH2突变(均为R172型),至今未有IDH3突变的报道。
有IDH1/IDH2基因突变的高级别胶质瘤预后明显好于无IDH1/IDH2基因突变的同类型胶质瘤,包括各级别胶质瘤的多方位研究也证实了IDH1基因突变和较好预后之间的相关性,多因素分析也提示IDH1基因突变是一个独自的良好预后标志物。迄今为止,尚无证据表明IDH1突变类型(R132H型与非R132H型)影响患者的生存率。也有一些研究报告证实,胶质瘤中IDH1基因突变与化疗反应之间没有明显的相关性。
MGMT启动子甲基化:MGMT定位于10q26,编码一种修复DNAO6-甲基鸟嘌呤的酶。其启动子包括含97个CG二核苷酸(CpG位点)的CpG岛。在正常组织中,MGMT的CpG位点一般都处在非甲基化状态。MGMT的CpG位点甲基化会导致染色体结构改变,从而阻止转录因子结合、导致MGMT基因的沉默。MGMT主要分布于细胞质,DNA损伤后才转移到细胞核。
在细胞核中,MGMT可以使烷化剂作用下形成的O6-甲基鸟嘌呤去甲基化,合适地修复DNA损伤,同时自身不可逆失活为烷基化MGMT。MGMT一个分子只能修复一个烷基加合物,因此,MGMT被称为自杀酶。细胞的修复能力取决于MGMT在细胞内的含量和合成速率,而MGMT基因启动子甲基化可以导致基因沉默和控制蛋白合成,阻碍DNA的修复。MGMT启动子甲基化在少突胶质细胞瘤中发生率为60%~80%,在少突-星形细胞瘤发生率为60%~70%,在GBM发生率为20%~45%,在间变性星形细胞瘤发生率为40%~50%,在毛细胞型星形细胞瘤发生率为20%~30%。在继发性GBM和低级别弥漫性胶质瘤中,MGMT启动子甲基化状态与IDH基因突变和1p/19q缺失的状态呈正相关。复发胶质瘤样本中MGMT启动子甲基化水平较一开始手术样本多有明显的增加,但胶质瘤患者的中位生存期只受初治胶质瘤中MGMT启动子甲基化状态的影响。MGMT启动子甲基化与胶质瘤对于烷化剂化疗的敏感性之间有密切关系。Hegi等报道,接受放疗和替莫唑胺治疗的患者,MGMT启动子甲基化者具有更长的生存期。
MGMT状态可提供预后信息,并对治疗选择有指导意义。通过甲基化特异性聚合酶链反应(MSP)检测MGMT启动子甲基化,不仅应用于实验研究,而且被列为临床常规诊断项目。
3.染色体1p/19q缺失:1p/19q联合性缺失是指1号染色体短臂和19号染色体长臂同时缺失,较早发现于少突胶质细胞瘤。1p/19q联合性缺失在少突胶质细胞瘤的发生率为80%~90%,在间变性少突胶质细胞瘤的发生率为50%~70%,在弥漫性星形细胞瘤发生率为15%,而在GBM发生率仅为5.0%。具有1p/19q联合性缺失的少突胶质细胞瘤患者通常伴随IDH基因突变及MGMT启动子甲基化和G-CPG岛甲基化(G-CIMP),但与TP53突变相互独自发生。
目前认为1p/19q联合性缺失是少突胶质细胞瘤的分子特征,是其诊断性分子标志物。通常对疑似少突胶质细胞瘤或少突-星形细胞瘤者均应进行1p/19q联合性缺失的检测,从而协助组织学诊断,且1p/19q缺失也有助于区分少突-星形细胞瘤更倾向于少突胶质细胞瘤还是星形细胞瘤,这对于治疗选择有的意义。1998年有学者一次报道,在间变性少突胶质细胞瘤中,有1p/19q联合性缺失的患者化疗效果更好,生存期更长。用替莫唑胺或单纯放疗治疗1p/19q联合缺失的少突胶质细胞瘤患者会延长其无进展生存期,有1p缺失的患者进行单一治疗无进展生存期也会延长。
4.EGFR扩增和EGFRvIII突变:表皮生长因子受体(epidermal growth factor receptor,EGFR)基因定位于染色体7p12,编码一种跨膜酪氨酸激酶受体。EGFR扩增在胶质瘤中发生率很高,并常伴随编码蛋白的过表达。间变性星形细胞瘤EGFR扩增的发生率为17%,GBM的发生率为50%~60%。FISH技术可以检测EGFR扩增,所以可作为判定肿瘤级别的备选指标。
在临床上,60岁以上的GBM患者伴随EGFR扩增提示预后不良。存在EGFR扩增的胶质瘤可以伴发其他EGFR基因的改变,较常见的是外显子2~7范围内缺失形成的EGFRvIII突变,GBM的EGFRvIII突变发生率为20%~30%,EGFRvIII编码缺少细胞外结构域的截短型EGFR蛋白。虽然截短型EGFR不能与其配体结合,但可通过自激活及进而激活下游信号转导通路发挥促肿瘤作用。EGFRvIII突变是否与预后相关还存在着争议,但长期随访资料显示EGFRvIII突变患者有预后差的趋势。然而,EGFRvIII突变为我们提供了一个分子靶向治疗的靶标,多项二期临床试验已发现针对EGFRvIII突变的疫苗能够好转患者的预后。有报道显示有望通过监测外周血EGFRvIII突变来观察EGFRvIII突变GBM患者对治疗的反应及监测其是否复发。
5.BRAF基因融合和点突变:BRAF原癌基因位于7q34,编码一种丝/苏氨酸特异性激酶,参与调控细胞内多种生物学过程,如细胞生长、分化和凋亡等。BRAF基因的串联重复导致了基因的融合,如KIAA1549-BRAF和FAM131B-BRAR(少见)。KIAA1549-BRAF融合在毛细胞型星形细胞瘤(PA;50%~70%)及多形性黄色瘤型星形细胞瘤(PXA;55.6%)中高发,而在其他胶质瘤或其他肿瘤中较为少见。KIAA1549-BRAF融合是一个重要的诊断标志物,由于PA也存在微血管增生,PXA在组织学上有时难以与GBM区分,如果检测有KIAA1549-BRAF融合则有助于PA和PXA与GBM的鉴别。
在各个级别的胶质瘤中,均检测到了BRAF发生在Val600Glu位点的错义突变(V600E)。通过针对该种突变的特异性抗体的免疫组织化学检测发现,多形性黄色瘤型星形细胞瘤中约有60%~70%发生该突变,是BRAFV600E突变较多的一种星形细胞瘤。在上皮样型胶质母细胞瘤和毛细胞型星形细胞瘤的发生率分别为53.8%和10%,其他胶质瘤中少见。针对BRAFV600E突变的药物,如威罗菲尼,为BRAFV600E突变型胶质瘤治疗提供了新的治疗方式。
6.Ki-67:Ki-67是一个395kD的抗原,其表达同细胞周期密切联系:Ki-67在G0和G1早期不表达,从G1期开始表达,在G2和S期表达量增加,至M期的表达量迅速下降。因此,Ki-67表达状况可反映肿瘤细胞的增殖活性和细胞周期的进行状况,是肿瘤细胞增殖的特异标志物。现在多使用免疫组织化学技术检测Ki-67蛋白,在病理诊断中已获得普遍认可。Ki-67表达于细胞核,其阳性表达率能客观反映肿瘤细胞的增殖活性及良恶性程度。在胶质瘤细胞中,其表达水平与肿瘤级别呈良好的正相关,可以作为胶质瘤病理分级及预后评估的重要参考指标。研究表明,Ki-67表达水平与胶质瘤患者的生存期及预后呈性负相关,Ki-67阳性表达率越高,肿瘤越容易复发,患者的生存时间越短。
- 文章标题:胶质瘤的分子标志物
- 更新时间:2021-11-16 11:31:49

 400-029-0925
400-029-0925