早在1994年Ruttledge等一次强调位于22q染色体上的NF2基因突变的流行情况时,脑膜瘤基因组景观就已经成为一个重要的研究领域。当时,人们都知道在高达80%的脑膜瘤中有22号染色体杂合性...
早在1994年Ruttledge等一次强调位于22q染色体上的NF2基因突变的流行情况时,
脑膜瘤基因组景观就已经成为一个重要的研究领域。当时,人们都知道在高达80%的脑膜瘤中有22号染色体杂合性缺失(LOH)存在。对22号染色体为LOH的肿瘤中NF2抑癌基因进行测序发现,大量肿瘤中存在NF2失活突变。在脑膜瘤中,22号染色体缺失的NF2基因很少发生突变,这证实了NF2基因在自发性脑膜瘤中具有抑瘤功能的双重打击假说。
值得注意的是,除了大规模的染色体异常和整体较高的突变负荷外,更高级别的肿瘤往往含有NF2突变。对脑膜瘤中NF2突变的进一步研究也显示,这些突变通常与凸面脑膜瘤而不是前颅底脑膜瘤相关(图1)。Merlin是由NF2编码的蛋白,是间接连接F-肌动蛋白、跨膜受体和细胞内效应蛋白的细胞内支架蛋白。它已被证明是一种通过接触控制和对在高细胞密度背景下导致Rac1通路的激活来控制细胞生长的肿瘤控制因子。因此,Merlin功能的丧失导致接触控制生长的丧失。NF2突变也导致Hippo、Notch、磷酸肌醇3-激酶(PI3K)/AKT、哺乳动物雷帕霉素靶蛋白(mTOR)和Ras/丝裂原活化蛋白激酶(MAPK)通路的激活,从而导致细胞增殖增加。如后面所述,对脑膜瘤分子生物学的深入研究已经确定了诸如酪氨酸激酶控制剂等药理药物的靶点,这些药物随后也会降低PI3K、mTOR和ERK通路的激活。
图1.在这篇综述中,脑膜瘤的常见颅内位置与相关的DNA驱动基因突变或染色体丢失相关。位置与从更少(绿色)到更复杂的切除术和管理(红色)的广义尺度相关。未见图示的脑膜瘤部位包括床突、枕骨大孔、海绵窦、鞍上和天幕。
鉴于40%的脑膜瘤中没有NF2突变,较近的研究集中于使用下一代测序技术,促进在大群患者中进行全基因组测序,以确定脑膜瘤肿瘤发生的其他驱动因素。2013年,两项评估脑膜瘤关键遗传特征的提出性研究发表。Clark等对300例WHO 1级和2级脑膜瘤进行测序后,发现了TRAF7(肿瘤坏死因子[TNF]受体相关因子7,tumor necrosis factor[TNF]receptor associated factor 7)、KLF4(Kruppel-like(样)因子4)、AKT1(v-akt鼠胸腺瘤病毒癌基因同源物1,v-akt murine thymoma viral oncogene homolog 1)和SMO(smoothened)的突变。有趣的是,这些额外的突变确定了三组位置不同但不重叠的肿瘤:发生在凸面和后颅底的具有染色体22 LOH和NF2基因突变的肿瘤,发生在前颅底中线的具有SMO的突变的肿瘤,以及发生在蝶骨翼和中颅底的具有TRAF7,AKT1和/或KLF4突变的肿瘤(图1)。对这些非NF2驱动基因突变的识别表明,脑膜瘤的基因组结构比之前假设的更加多样化,导致识别出额外的脑膜瘤驱动基因突变,包括POLR2A、SMARCB1种系变异(包括SMARCE1)、AKT3、PIK3CA、PIK3R1、PRKAR1A、SUFU和BAP1。与此同时,Brastianos等对17个脑膜瘤进行了基因组测序,并对另外48个脑膜瘤进行了靶向测序,发现WHO 1级脑膜瘤的基因组损害率低于全身系统性肿瘤或WHO 2级或3级脑膜瘤。在发现集中(In the discovery set),一些1级脑膜瘤发现染色体1p、7p、14p和19的拷贝数丢失,5号和10号染色体的拷贝数增加,而从较高级别的肿瘤中发现染色体10q和14q的拷贝数丢失。靶向基因分析发现NF2(较常见的突变)、KDM5C、SMO、AKT1、RGPD3和CD300C存在非同义突变。特异性SMO突变是已知的基底细胞癌和促结缔组织成神经管细胞瘤的致癌突变,仅在无NF2改变的脑膜瘤中发现。同样,AKT1突变是先前在乳腺癌、结直肠癌和肺癌中描述过的致癌突变,与脑膜瘤中的NF2或SMO突变相互排斥。在验证队列中,在颅底和更高级别脑膜瘤中观察到AKT1和SMO突变。Clark等和Brastianos等的发现共同为将基因组改变纳入2021年WHO分类奠定了基础。
WHO3级脑膜瘤的基因谱系历来没有很好得到描述。为了解决这个问题,Bi等分析了134例高级别脑膜瘤。在他们对高级别脑膜瘤研究中,大多数肿瘤以NF2突变为特征,很少肿瘤有TRAF7、KLF4、AKT1和SMO突变,这表明高级别脑膜瘤很少有可靶向的基因突变。AKTI/PIK3CA突变与脑膜细胞亚型、NF2突变与成纤维细胞亚型、TRAF7/KLF4突变与分泌亚型也有相关报道。Bi等也发现,高级别病变的特点是拷贝数改变增加,有趣的是,发展为高级别脑膜瘤的低级别病变表现出类似于高级别脑膜瘤的基因组损害模式,并与激活TERT启动子突变有关。存在TERT启动子的突变进一步与进展和生存差相关。该观察结果与其他组的结果相结合,表明CDKN2A/B或BAP1突变纯合缺失与的临床结局之间存在很强的相关性,导致2021年WHO标准的修订。
虽然2021年的分类建议考虑测序,但它对诊断不是必需的。尽管如此,目前的标准现在集成了驱动基因突变,如常规型的NF2、AKT1、SMO和PIK3CA,分泌型的TRAF7和KLF4,透明细胞型的SMARCE1,横纹肌亚型的BAP1。此外,无论组织学分级如何,具有TERT启动子突变或CDKN2A/B纯合缺失的脑膜瘤都被归类为3级间变性肿瘤。
表达谱和表观基因组分析
鉴于WHO分级和DNA突变不能较优地评估脑膜瘤的临床行为,较近的研究使用了几种分子分析技术来创建更符合脑膜瘤临床过程的分类方案(表1)。许多研究小组假设染色质结构和基因表达谱主要由DNA甲基化控制,在这方面可能更有用。例如,是在2级脑膜瘤中,经免疫组化识别的H3K27三甲基(H3K27me3)缺失已被证实为生存差和复发时间短的标志。
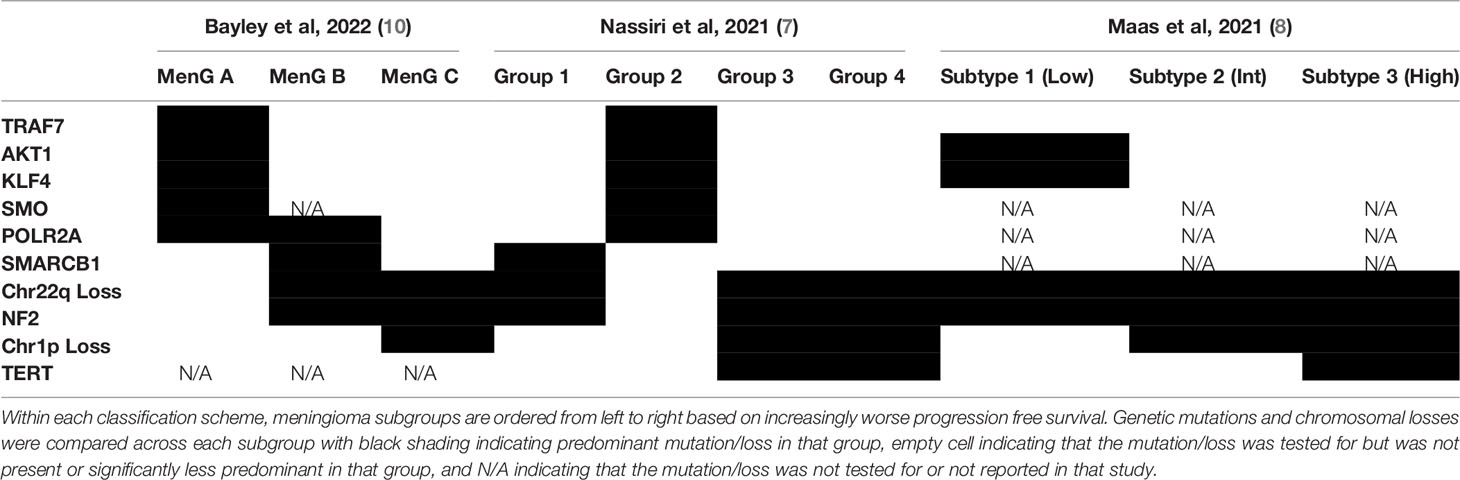
表1.对脑膜瘤分子重分类研究的比较。
(在每个分类方案中,根据无进展生存期日益恶化从左到右对脑膜瘤亚组排序。对每个亚组的遗传突变和染色体缺失进行比较,黑线表示该亚组中占主导地位的突变/缺失,空细胞表示在该亚组中检测的突变/缺失,不存在或劣势,N/A表示该研究未检测或未报告突变/缺失。)
2017年,Sahm等对497个全部WHO级别的脑膜瘤和309个组织学上类似脑膜瘤的轴外肿瘤进行了全基因组甲基化分析。无管理的群集(Unsupervised clustering)不仅将脑膜瘤与其他肿瘤分离开来,而且还确定了脑膜瘤的6个临床相关甲基化类别。三个分类聚在一起,并根据其更良性的临床过程被定义为良性1至3级甲基化类(MC ben-1至MC ben-3)。被定义为中间甲基化类A和中间甲基化类B(MC int-A和MC int-B)的无进展生存期为中间级,而较终甲基化类恶性(MC mal)的无进展生存期明显较差。值得注意的是,虽然WHO 1级脑膜瘤在良性甲基化类别中富集,WHO3级脑膜瘤在恶性甲基化类别中富集,但WHO2级病变通常具有异质性的临床过程,分布在除一个甲基化类别外的全部甲基化类别中。此外,除MC ben-2外,至少30%的甲基化类别中发现了NF2突变。与基因组测序研究结果一致,非NF2和NF2突变几乎相互排斥,非NF2突变在MC ben-2中富集,而NF2突变在这一组中少见。综合来看,这些发现表明甲基化级别在评估临床行为方面优于WHO级别。特别是在WHO分级2级的肿瘤中,虽然NF2突变状态可能不是临床行为的完全特异性评估因子,但非NF2驱动基因突变可能有助于识别具有更具良性临床过程的脑膜瘤。
2019年,Patel等报告了他们的分类方案,基于对160个脑膜瘤的整体RNA测序和全外显子组测序分析。他们也报告了3个分子亚组,即A型、B型和C型,它们比WHO分级方案更可靠地评估了复发。有趣的是,他们发现,根据WHO的分级标准,在较具进袭性的C型肿瘤中,超过一半的肿瘤被评估为良性。与之前的研究一样,研究发现,进袭性较低的肿瘤(A型)没有的拷贝数改变,而进袭性较高的肿瘤(C型)有较大的22q和1p染色体缺失率。重要的是,B型和C型肿瘤的基因集富集分析显示,B型肿瘤中PRC2复合体功能缺失,C型肿瘤中DREAM复合体功能缺失,这一发现可能会指导未来的靶向治疗策略。
较近,Nassiri等利用甲基化阵列、大体积RNA测序和全外显子组测序分析对121例脑膜瘤进行了综合分析,以开发一个比WHO分级系统更好地评估预后的综合分类系统。他们确定了脑膜瘤的4个分子亚群:MG1-4、并根据富集基因的通路分析指定每个亚组:免疫原性(MG1)、良性NF2野生型(MG2)、高代谢性(MG3)和增殖型(MG4)。有趣的是,将药物定位到靶点富集基因可以识别出特定脑膜瘤亚型的候选药物。例如,定位于MG4亚型的组蛋白去乙酰化酶控制剂vorinostat在体外可特异性降低MG4脑膜瘤细胞系的活力,在体内可降低MG4异种移植物的大小。且凸显出脑膜瘤的分子分析在分类和新疗法开发中的价值。
Maas等和Bayley等也同样创建了脑膜瘤分类系统,该系统集成了甲基化阵列数据、拷贝数改变、DNA突变、和组织病理学结果,以更好地分层患者(表2)。重要的是,Maas等=证明,可以很容易地从甲基化阵列推断出拷贝数改变数据,从而简化脑膜瘤的分子诊断检查。尽管他们也根据资源的可用性提供了分层的替代方法(靶向基因分析或FISH)。Bayley等对WHO 1级和2级脑膜瘤结合DNA甲基化、RNA-seq(测序)和细胞遗传学分析进行分析,产生了3个脑膜瘤亚群,两个恶性和一个良性。值得注意的是,染色体1p缺失与恶性肿瘤密切相关。这些综合模型RNA测序、细胞发育分析或DNA甲基化相比,在预后方面具有更高的准确性。

表2.对目前进袭性脑膜瘤预后的比较。
比较了四种目前脑膜瘤分级模式的关键因素,包括遗传和表观遗传改变、组织学特征和临床特征。在每个分类方案中,黑色阴影表示在评估评分中使用了该因素。
同时,Driver等将15个靶向高危分子改变(13个染色体改变和CDKN2A/B缺失)与组织学(频繁有丝分裂)和临床(切除范围、肿瘤体积和复发状态)因素结合起来分层脑膜瘤。该分类系统强调了纳入CDKN2A突变的重要性,其分类系统导致32%的肿瘤被重新分类为比WHO分级更高或更低的风险综合分级。这些较近的研究表明,需要考虑分子和组织病理学特征的结合,以实现脑膜瘤的准确分层。事实上,机器学习技术的使用可能能将更多的信息,如肿瘤的MRI特征,纳入到综合分级模式中,从而更准确地对脑膜瘤分层。
- 文章标题:进袭性脑膜瘤鉴别之基因组分析——2021年国际卫生组织中枢神经系统肿瘤分类
- 更新时间:2022-06-09 17:40:37
-
脑膜瘤需要通过开颅手术切除。手术切口应根据肿瘤的具体生长部位进行设计。在手术过...
2019-06-03 01:09:00
-
枕骨大孔区脑膜瘤切除术是较富有挑战性的手术之一,原因在于肿瘤基部常位于枕骨大孔...
2022-01-10 15:50:16
-
脑血管瘤与脑膜瘤的区别?4种检查方式!脑血管瘤和脑膜瘤是两种不同类型的颅内肿瘤...
2023-11-20 17:51:11
-
脑膜瘤是较常见的原发性脑肿瘤之一,约占中枢神经系统肿瘤的30%。本文盘点了脑膜瘤复...
2021-08-03 11:24:55
-
位于C2椎体水平以下的脑膜瘤称为脊髓 脑膜瘤 。脑膜瘤是二常见的肿瘤,仅次于神经鞘...
2020-04-22 18:10:26
-
脑膜瘤会复发吗?如果你被诊断出患有脑膜瘤经历了脑肿瘤手术要去除它,你可能渴望回...
2022-07-28 16:56:10
-
血管型脑膜瘤的症状有哪些?怎么治?血管型脑膜瘤是一种较为不同且严重的脑膜瘤类型...
2023-11-15 17:30:38
-
一位两个孩子的母亲将头痛和疲劳视为怀孕的症状,她透露了自己是如何在分娩后三周被...
2020-09-21 13:26:47
-
脑膜瘤 是生长缓慢的轴外肿瘤,起源于中枢神经系统的蛛网膜帽细胞。脑膜瘤约占颅内...
2019-10-28 15:51:04
-
脑膜肉瘤和脑膜瘤的区别?总结4个方面!脑膜肉瘤和脑膜瘤是两种不同的疾病,脑膜肉...
2023-12-07 14:49:16
-
鞍结节脑膜瘤的常见首发症状是什么?怎么检查?鞍结节脑膜瘤是一种常见的脑瘤,它通...
2023-11-29 17:29:20
-
海绵窦脑膜瘤手术难度大吗? 海绵窦脑膜瘤(CSMs)是颅底神经外科医生处理的具有挑战性...
2022-09-06 17:00:02
-
日常生活中常出现的肩颈疼痛,往往会被认为是颈椎病,而忽略其他疾病的可能。50多岁...
2024-06-23 21:29:10
-
鞍区脑膜瘤邻近解剖复杂,是指发生在鞍区脑膜及脑膜间隙肿瘤,主要包括起源于鞍结节...
2022-06-06 11:01:09
-
矢状窦旁脑膜瘤是一种常见的颅内肿瘤,起源于脑膜,通常位于颅底的矢状窦旁区域。虽...
2023-04-25 19:42:03
-
桥小脑角区脑膜瘤是一种位于脑干和小脑之间的肿瘤。它起源于脑膜,是一种较为少见的...
2023-08-23 18:06:01
-
枕骨大孔区脑膜瘤患者初始症状不明显,患者多出现颈枕部的疼痛,颈部活动或者咳嗽等...
2022-01-11 17:18:50
-
脑膜瘤是由正常分布于蛛网膜小梁的脑膜帽细胞引起的脑肿瘤,脑膜瘤通常在大脑凸面、...
2021-07-29 14:11:16
-
脑膜肉瘤遗传吗?脑膜肉瘤的遗传性并不是很明确,大部分情况下它是由一系列遗传和环...
2023-12-25 16:46:20
-
岩斜区脑膜瘤能治愈吗?岩斜区脑膜瘤是一种良性的缓慢生长的肿瘤,发生在颅底中央深...
2022-08-06 14:54:27



