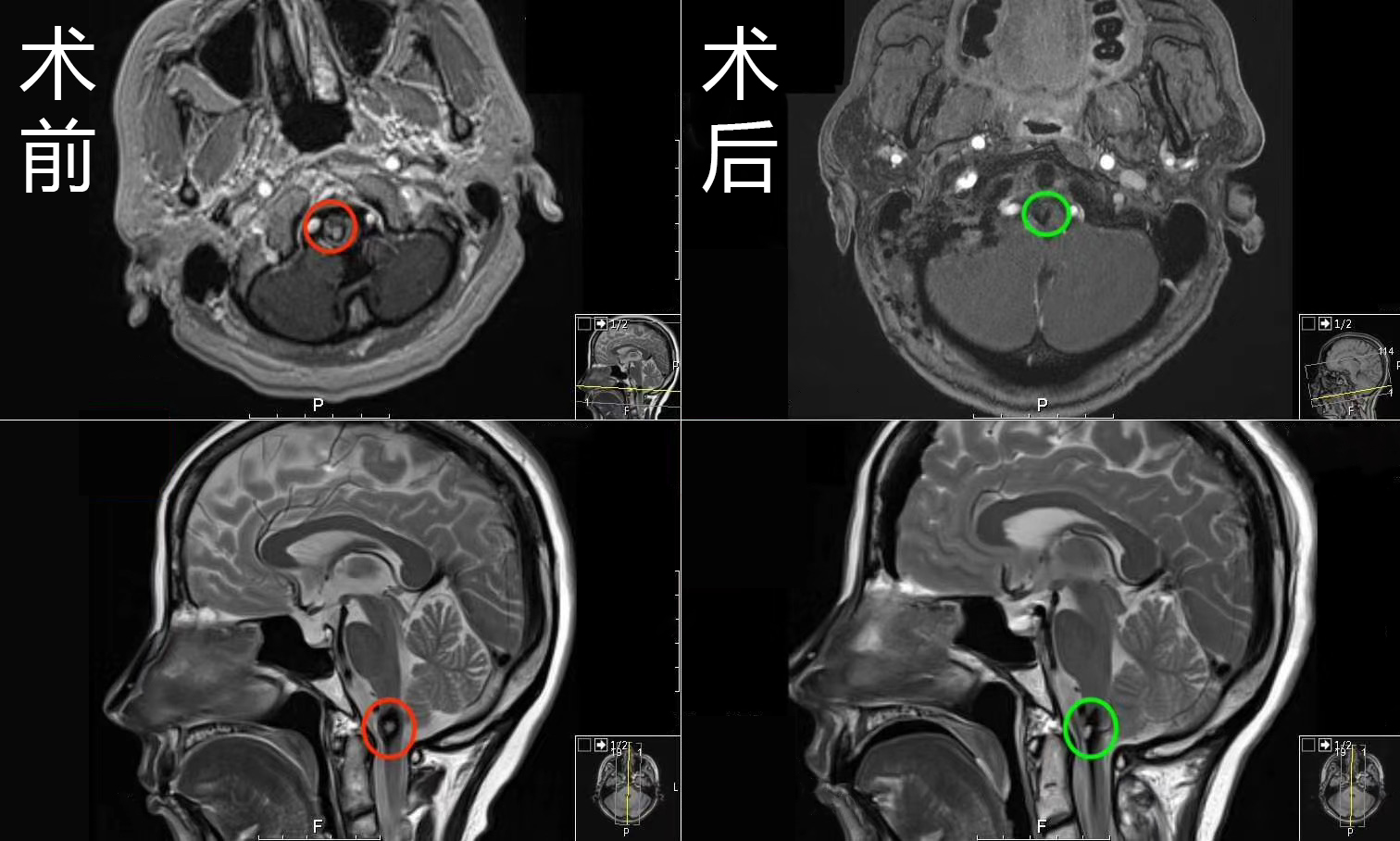
星形细胞瘤和少突胶质细胞瘤虽然同属弥漫性胶质瘤,但它们的分子特征、生物学行为和临床管理策略存在本质差异呢。简单来说,IDH突变型星形细胞瘤以IDH基因突变联合ATRX/TP53突变为核心特征,而少突胶质细胞瘤必须同时存在IDH突变和1p/19q共缺失。这种分子基础的分野,直接导致了两类肿瘤在影像表现、治疗敏感性和生存预后上的显著不同。例如,少突胶质细胞瘤的钙化率高达70%-90%,化疗敏感性提升2.3倍;而星形细胞瘤更易进展为高级别,CDKN2A/B缺失直接将其推向WHO 4级。理解这些区别,对制定个体化治疗方案至关重要呀。推荐阅读:星形细胞瘤百科
一、分子机制:驱动肿瘤发展的基因密码
两类肿瘤的分子特征差异是诊断和治疗的基石。这些遗传改变不仅决定肿瘤分类,还直接影响细胞行为和药物反应。
IDH突变的不同协同模式
•星形细胞瘤:
•IDH1/2突变(异柠檬酸脱氢酶基因突变)触发D-2HG(D-2-羟基戊二酸)积累,干扰细胞代谢
•协同TP53突变(抑癌基因失活)和ATRX缺失(染色质重塑异常),形成“分子三联征”
•缺乏1p/19q共缺失,这是与少突胶质细胞瘤的核心鉴别点
•少突胶质细胞瘤:
•IDH突变基础上必须存在1p/19q共缺失(染色体1p和19q整臂缺失)
•常伴TERT启动子突变(端粒酶逆转录酶基因突变),维持端粒长度
这种差异可通过免疫组化初步筛查:星形细胞瘤表现为ATRX核表达缺失和p53强阳性,而少突胶质细胞瘤保留ATRX表达。
分级标志物的临床意义
•星形细胞瘤的升级信号:
•CDKN2A/B纯合缺失直接定义为WHO 4级,即使无坏死或微血管增生
•中国多中心研究显示,CDKN2A/B缺失患者生存期缩短50%以上
•少突胶质细胞瘤的分级依据:
•WHO 3级需满足核分裂像≥6个/10高倍视野
•无CDKN2A/B缺失的预后影响
分子检测已成为诊断金标准。2021年WHO分类强调,约8%形态学诊断为星形细胞瘤的病例因缺乏IDH突变需重新分类。

二、临床与影像表现:从症状到扫描的差异图谱
两类肿瘤的生长特性和影像特征直接影响诊断思路和治疗优先级。
生长模式与解剖偏好
•星形细胞瘤:
•好发于大脑深部(如丘脑、脑干),儿童脑干型占15%-20%
•呈弥漫浸润性生长,易跨脑叶播散(多脑叶侵犯率比少突高2.1倍)
•少突胶质细胞瘤:
•83%位于额叶表浅部位,边界相对清晰
•局限性生长,侵袭性较低
这种差异解释了症状差异:额叶少突胶质细胞瘤患者中,60%以癫痫首发;而脑干星形细胞瘤儿童更多表现共济失调。
影像学的鉴别关键点
| 特征 | 星形细胞瘤 | 少突胶质细胞瘤 |
| CT钙化 | <30%微钙化 | 70%-90%弯曲条带状钙化 |
| MRI水肿 | 范围水肿指数>3(中度以上) | 水肿指数<2(轻度或无) |
| 强化程度 | WHO 3级以上中度强化占90% | WHO 2级仅15%-20%轻度强化 |
| DWI-ADC值 | <1.0×10⁻³mm²/s(高级别) | >1.1×10⁻³mm²/s |
| MRS特征 | 高Lipid/lac峰乳酸峰 | +Cho/NAA比值2.0-3.0 |
影像组学研究证实,少突胶质细胞瘤的“云雾状”T2高信号对1p/19q共缺失的阳性预测值达78%。
三、治疗策略:化疗敏感性与方案选择
分子差异直接决定两类肿瘤对治疗的反应,这要求临床决策需“量体裁衣”。
化疗方案的分层选择
•少突胶质细胞瘤:
•PCV方案(丙卡巴肼+洛莫司汀+长春新碱)为首选,缓解率比替莫唑胺高34%
•1p/19q共缺失使肿瘤对烷化剂敏感性提升2.3倍
•星形细胞瘤:
•替莫唑胺是基础药物,尤其MGMT启动子甲基化者(有效率56%-81%)
•IDH抑制剂(如Vorasidenib)对WHO 2级肿瘤进展风险降低61%
值得注意的是,少突胶质细胞瘤中MGMT甲基化率高达81.08%,显著高于星形细胞瘤的56.52%,这进一步增强了化疗响应。
放疗与手术的差异考量
•少突胶质细胞瘤:
•全切术后可推迟放疗,5年生存率74%
•放疗剂量54Gy足够,避免过度治疗
•星形细胞瘤:
•WHO 3/4级需术后6周内启动同步放化疗(59.4Gy+替莫唑胺)
•CDKN2A/B缺失者即使WHO 2级也建议早期干预
对于功能区肿瘤,少突胶质细胞瘤的清晰边界使全切率可达82%,而星形细胞瘤因浸润性常仅实现次全切。
四、预后影响因素:生存曲线的分水岭
两类肿瘤的生存差异不仅在于分级,更与分子风险和动态监测策略相关。
生存数据的直接对比
•少突胶质细胞瘤:
•WHO 2级:10年生存率>60%,中位生存期超14年
•1p/19q共缺失者PCV化疗后生存期延长3.8年
•星形细胞瘤:
•WHO 2级:平均生存>10年,但35%在10年内进展
•WHO 4级:中位生存仅3年,CDKN2A/B缺失者更短
中国研究显示,相同WHO 2级患者,少突胶质细胞瘤的无进展生存期(PFS)显著优于星形细胞瘤(HR=1.82,P=0.034)。
动态风险评估模型
少突胶质细胞瘤的预后受年龄与Ki-67指数主导:
•40岁以下全切者10年生存率>80%
•Ki-67>8%者进展风险增加2.1倍
星形细胞瘤则需关注分子进化:
•30%复发肿瘤获得PIK3CA或PDGFRA新突变
•替莫唑胺诱导20%病例出现超突变
因此NCCN指南建议:星形细胞瘤复发时需重新活检,而少突胶质细胞瘤可依赖液体活检监测1p/19q状态。
五、特殊亚型:诊断陷阱与应对策略
部分罕见变异易混淆诊断,需分子技术精准识别。
高误诊风险亚型
1.伴原始神经元成分的星形细胞瘤(ASTRO PNC):
•占IDH突变型星形细胞瘤的3%-5%
•79%表达TTF-1(甲状腺转录因子-1),常误诊为转移癌
•软脑膜播散风险增加2.4倍
2.原发错配修复缺陷型星形细胞瘤:
•儿童多见,中位年龄14岁
•替莫唑胺耐药率>80%,需联合免疫治疗
分子鉴别技术
•DNA甲基化分型:ASTRO PNC显示独特甲基化谱,区别于常规星形细胞瘤
•RNA测序:少突胶质细胞瘤需排除CIC/FUBP1突变干扰1p/19q解读
这类亚型的处理原则是:当影像显示颞叶占位伴TTF-1阳性时,即使疑似转移灶也应加做IDH1测序。
常见问题答疑
Q1:病理报告未提1p/19q,能确诊少突胶质细胞瘤吗?
不能!1p/19q共缺失是诊断必要条件。若未检测,应归类为“NOS(未特指型)胶质瘤”,需补做FISH或甲基化检测。
Q2:IDH突变型星形细胞瘤会变成少突型吗?
不会。二者起源细胞不同,分子路径独立。但少突胶质细胞瘤可能含星形成分(少突星形细胞瘤),需按主导成分分类。
Q3:儿童少突胶质细胞瘤常见吗?
罕见(<5%)。儿童脑干胶质瘤多为H3K27突变型星形细胞瘤,需区分。
Q4:MGMT甲基化高低如何影响治疗?
高甲基化者替莫唑胺有效率提升3倍。少突胶质细胞瘤甲基化率81%,更受益于化疗;星形细胞瘤若未甲基化,需考虑PCV或靶向治疗。
Q5:电场治疗(TTFields)对哪类有效?
目前仅推荐用于CDKN2A缺失的WHO 4级星形细胞瘤,联合替莫唑胺使2年生存率从28%升至46%。
- 文章标题:星形细胞瘤和少突胶质细胞瘤,名字就差俩字,实际区别可不小!看完秒懂
- 更新时间:2025-08-22 15:39:34

 400-029-0925
400-029-0925