当病理报告中出现 "组织细胞肉瘤" 的诊断时,患者常常会被这一陌生的术语所困扰:这种起源于 "组织细胞" 的疾病究竟是良性增生还是恶性肿瘤?是否会像家族遗传病一样影响下一代?手术能否彻底切除病灶?作为一种罕见的造血系统恶性肿瘤,组织细胞肉瘤(Histiocytic Sarcoma, HS)的临床认知度虽不及淋巴瘤或白血病,但因其独特的生物学行为和治疗挑战,需要从病理本质、遗传机制、治疗策略等多个维度进行科学解读。我们将围绕这三个核心问题展开深入分析,结合最新临床研究成果,为患者及家属提供全面的医学参考。

一、组织细胞肉瘤病理本质:从组织细胞到恶性肿瘤的蜕变
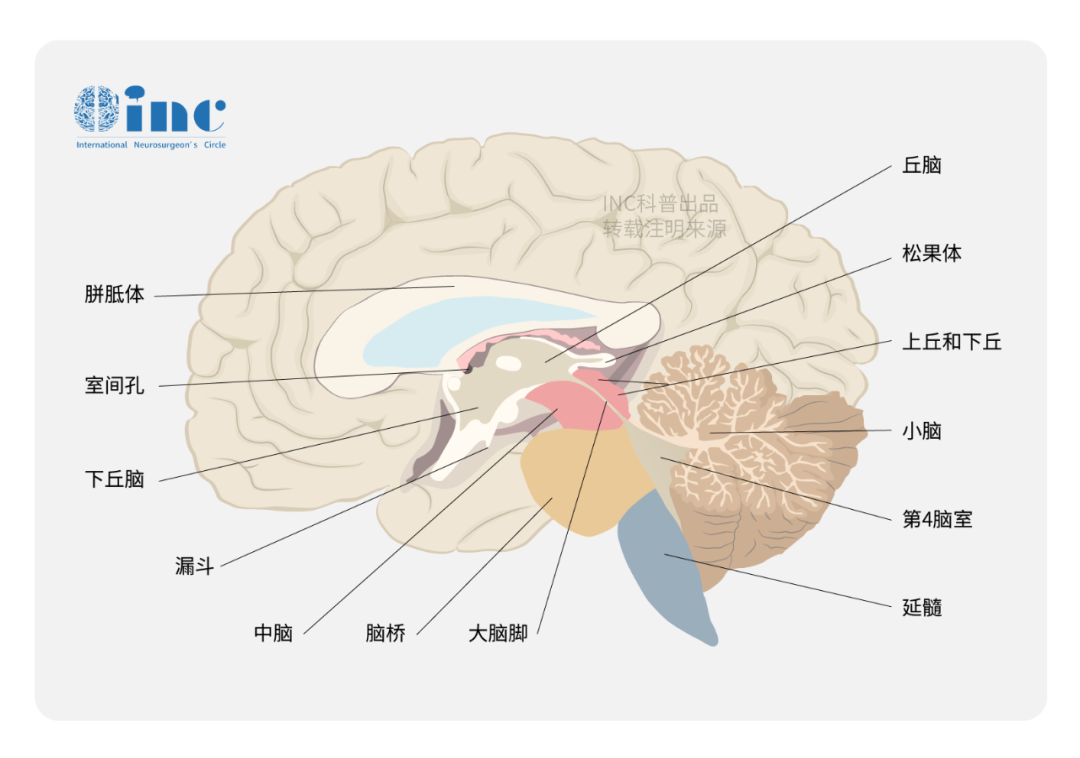
(一)组织细胞的生物学定位
要理解组织细胞肉瘤的性质,需先明确 "组织细胞" 的生物学定义。这类细胞属于单核 - 巨噬细胞系统,是人体免疫系统的重要组成部分,起源于骨髓造血干细胞,经单核细胞分化为定居于各组织器官的巨噬细胞(如肝脏库普弗细胞、肺脏肺泡巨噬细胞)或树突状细胞。正常生理状态下,组织细胞承担着清除衰老细胞、吞噬病原体、参与抗原呈递等关键免疫功能,其增殖分化受严格调控。
(二)恶性转化的分子特征
组织细胞肉瘤的本质是组织细胞发生恶性转化,形成具有侵袭性的肿瘤细胞。与良性组织细胞增生性疾病(如朗格汉斯细胞组织细胞增生症)不同,HS 细胞表现出明显的恶性生物学行为:
形态学异常:显微镜下可见肿瘤细胞体积增大,胞质丰富嗜酸性,核仁明显,核分裂象增多(>5 个 / 10 高倍视野),并常伴有坏死灶。
免疫表型特征:肿瘤细胞表达单核 - 巨噬细胞相关标记(如 CD68、CD163),但通常不表达树突状细胞标记(如 CD1a、S-100),与经典型霍奇金淋巴瘤或弥漫大 B 细胞淋巴瘤的免疫表型存在显著差异。
侵袭转移能力:HS 可侵犯邻近组织器官,并通过血液循环或淋巴系统转移至肝、脾、骨髓等部位,约 30% 的患者初诊时已出现远处转移。
(三)与相关疾病的鉴别诊断
临床中需与以下疾病进行鉴别:
良性组织细胞增生症:如噬血细胞性淋巴组织细胞增生症(HLH),虽有大量组织细胞增生,但属于反应性病变,无克隆性增殖证据,临床表现以发热、血细胞减少为特征,而非占位性病变。
恶性淋巴瘤:部分大 B 细胞淋巴瘤可伪装为组织细胞肉瘤,需通过流式细胞术检测免疫球蛋白轻链限制性表达,或基因重排检测确认 B 细胞克隆性。
肉瘤样癌:上皮来源的肉瘤样病变,免疫组化表达上皮标记(如 CK、EMA),可资鉴别。
综上,组织细胞肉瘤属于罕见的恶性肿瘤,发病率约为 0.1-0.2/100 万,占所有造血系统恶性肿瘤的不足 1%。其恶性特征不仅体现在形态学异型性,更表现为侵袭性生长和远处转移能力,需与良性增生性疾病严格区分。
二、组织细胞肉瘤遗传机制:散发性为主的潜在风险因素
(一)家族性病例的文献回顾
目前全球报道的家族性组织细胞肉瘤病例不足 50 例,多为个案报告。例如 2019 年《Blood》杂志报道的一家系中,兄妹两人先后诊断为 HS,均携带 NRAS 基因突变,但进一步基因筛查显示其父母及子女未携带该突变,提示可能为体细胞突变而非生殖细胞遗传。另有研究发现,某些遗传性免疫缺陷病(如 GATA2 基因突变综合征)患者发生 HS 的风险较常人高 10-20 倍,但其致病机制与免疫系统监视功能缺陷相关,而非直接遗传倾向。
(二)体细胞突变谱的研究进展
通过二代测序技术,研究者在 HS 肿瘤组织中发现多种体细胞突变:
MAPK 通路异常:约 40% 的病例存在 NRAS、KRAS 或 BRAF 突变,与朗格汉斯细胞组织细胞增生症的突变谱有重叠,提示该通路激活可能在组织细胞恶性转化中起重要作用。
表观遗传调控异常:TET2、IDH1/2 突变发生率约 20%-30%,参与 DNA 甲基化修饰,导致基因表达紊乱。
抑癌基因失活:TP53 突变率约 15%,常伴随 p53 蛋白功能丧失,破坏细胞周期调控。
值得注意的是,这些突变均为获得性体细胞突变,不存在于生殖细胞中,因此不会直接遗传给后代。

(三)环境与遗传的交互作用
尽管缺乏明确的遗传倾向,以下因素可能增加发病风险:
免疫抑制状态:器官移植后长期使用免疫抑制剂者,HS 发病率较常人高 3-5 倍,可能与 T 细胞免疫监视功能低下相关。
慢性炎症刺激:长期患慢性骨髓炎、自身免疫性疾病(如类风湿关节炎)的患者,组织细胞持续活化可能增加恶性转化风险。
病毒感染:人类疱疹病毒 8 型(HHV-8)在部分 HS 病例中检出,但因果关系尚未明确。
目前证据表明,组织细胞肉瘤以散发性病例为主,生殖细胞层面的遗传倾向尚未证实。家族性病例极为罕见,且可能与特定基因突变或免疫缺陷相关,普通人群无需过度担忧遗传传递问题。
三、组织细胞肉瘤手术治疗:早期根治的核心策略
(一)手术切除的临床价值
手术是局限性组织细胞肉瘤的首选治疗方式,其核心目标在于:
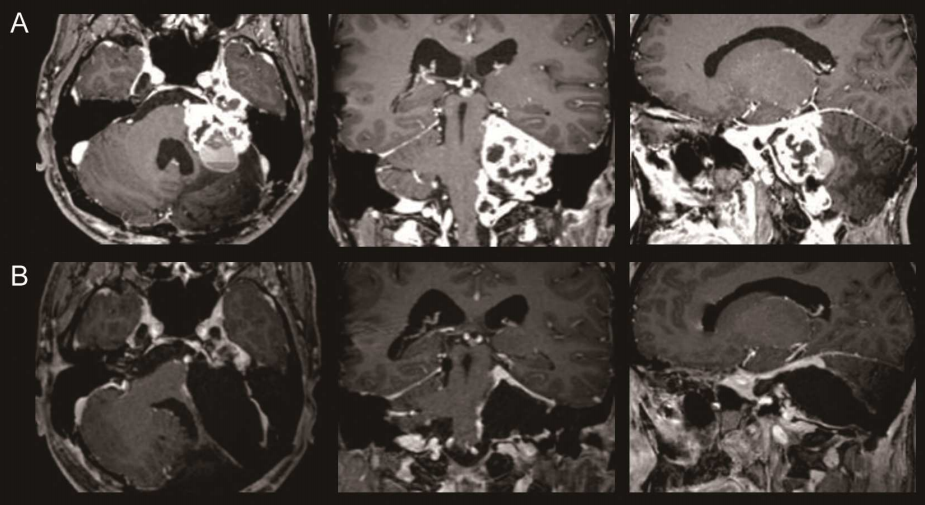
明确病理诊断:通过完整切除病灶获取足够组织标本,避免穿刺活检的取材局限。
根治性治疗:对于 Ⅰ-Ⅱ 期患者,手术切除可达到治愈目的,文献报道完全切除后的 5 年无病生存率可达 60%-70%。
缓解症状:对压迫重要器官(如肠道、呼吸道)的肿瘤,手术可迅速解除占位效应,改善生活质量。
(二)影响切除率的关键因素
肿瘤位置与分期:
有利部位:体表或腹腔内孤立性肿块(如肠系膜、腹膜后)切除率较高,尤其是未侵犯重要血管神经者。
困难部位:颅内、纵隔或累及多器官的肿瘤,因解剖结构复杂,完整切除率仅 30%-40%。
分期影响:初诊时局限于单一器官(Ⅰ 期)的患者,手术切除率可达 80%;而伴有区域淋巴结转移(Ⅱ 期)或远处转移(Ⅲ-Ⅳ 期)者,完整切除率降至 50% 以下。
肿瘤生物学行为:
高侵袭性肿瘤(如核分裂象 > 10 个 / 10 高倍视野、伴有坏死)常与周围组织粘连紧密,增加手术难度。
部分病例表现为多中心起源或弥漫性浸润,如累及肝脾的 HS,难以通过手术彻底清除。
(三)围手术期治疗策略
新辅助治疗:对于巨大肿瘤或侵犯重要结构的病例,术前可给予化疗(如 CHOP 方案)或靶向治疗(如 MEK 抑制剂针对 MAPK 通路突变患者),缩小肿瘤体积以提高切除率。2023 年《Leukemia》研究显示,新辅助治疗可使 30% 的不可切除病例转化为可手术状态。
术后辅助治疗:
切缘阳性(R1 切除)或淋巴结转移患者,需接受术后放疗(剂量 50-60Gy),降低局部复发风险。
对于高风险病例(如 Ⅲ-Ⅳ 期、TP53 突变阳性),术后推荐联合化疗或免疫治疗(如 PD-1 抑制剂),延长无病生存期。
微创手术的应用:
对于体表或腹腔内较小病灶,腹腔镜、胸腔镜等微创手术方式可达到与开放手术相当的切除效果,且具有创伤小、恢复快的优势,但需严格评估肿瘤边界和操作空间。
(四)复发与转移的外科处理
术后复发多发生在 2 年内,以局部复发(50%)和远处转移(30%)为主。对于孤立性复发灶,再次手术切除仍可能带来生存获益,文献报道二次手术后 5 年生存率可达 40%。但对于多发转移或累及重要器官(如脑、骨髓)的病例,手术价值有限,需转为系统治疗。
组织细胞肉瘤的手术切除率因肿瘤位置、分期及生物学行为而异。早期局限性病变通过完整切除可获得良好疗效,而晚期或侵袭性病例需结合多学科治疗。手术在诊断确立、根治性治疗及症状缓解中均具有不可替代的作用,是综合治疗的重要基石。

四、组织细胞肉瘤临床常见问题解析
1. 组织细胞肉瘤与淋巴瘤有何本质区别?
二者均起源于造血系统,但组织来源不同:淋巴瘤起源于淋巴细胞(B 细胞或 T 细胞),而 HS 起源于单核 - 巨噬细胞。免疫表型上,淋巴瘤表达淋巴细胞标记(如 CD20、CD3),而 HS 表达单核 - 巨噬细胞标记(如 CD68、CD163)。此外,淋巴瘤常表现为淋巴结肿大,而 HS 更易形成实体瘤,侵犯结外器官(如胃肠道、肝脏)。
2. 靶向治疗在组织细胞肉瘤中有哪些进展?
针对 MAPK 通路突变的靶向药物已进入临床试验:
BRAF V600E 突变:维莫非尼、达拉非尼等 BRAF 抑制剂,单药有效率约 30%-40%,联合 MEK 抑制剂(如曲美替尼)可提升至 60%。
NRAS/KRAS 突变:司美替尼(MEK 抑制剂)在 Ⅰ/Ⅱ 期研究中显示疾病控制率达 55%,尤其适合无法耐受化疗的老年患者。
免疫治疗:PD-1 抑制剂(如帕博利珠单抗)单药有效率约 20%,与 CTLA-4 抑制剂联合应用可激活抗肿瘤免疫,适用于复发 / 难治性病例。
3. 儿童与成人组织细胞肉瘤的表现有何不同?
儿童病例罕见,仅占所有 HS 的 5%-10%,多表现为皮肤、软组织肿块,常伴发热、贫血,易误诊为朗格汉斯细胞组织细胞增生症。成人更常见于胃肠道、肝脾等深部器官,起病隐匿,常以腹痛、体重下降为首发症状。儿童患者中 NRAS 突变率较高(约 50%),而成人 BRAF 突变更常见(约 35%),治疗策略需结合年龄和突变谱调整。
4. 术后随访需要关注哪些指标?
影像学检查:每 3-6 个月进行全身 CT/MRI 扫描,监测局部复发和远处转移,PET-CT 可用于评估肿瘤活性。
血液学检测:定期检查血常规、肝肾功能,关注炎症指标(如 CRP、IL-6)和肿瘤标记物(目前尚无特异性指标,可动态观察 sCD163 水平)。
免疫功能评估:接受免疫抑制治疗或干细胞移植的患者,需监测 T 细胞亚群、免疫球蛋白水平,预防机会性感染。
5. 组织细胞肉瘤的预后如何?哪些因素影响生存?
总体 5 年生存率约 40%-50%,预后相关因素包括:
分期:Ⅰ 期患者生存率 > 60%,Ⅳ 期降至 20% 以下。
体能状态:ECOG 评分≥2 分者预后差,中位生存期 < 12 个月。
分子特征:TP53 突变、复杂核型异常提示不良预后,而 MAPK 通路突变患者对靶向治疗反应较好。
治疗反应:一线治疗后达到完全缓解者,5 年生存率是部分缓解者的 2 倍(70% vs 35%)。
结语
组织细胞肉瘤虽为恶性肿瘤,但其临床行为与治疗策略具有显著异质性。早期识别、精准诊断及多学科协作是改善预后的关键:良性与恶性的鉴别需依赖病理与分子检测,遗传风险可通过家族史评估和基因筛查排除,手术治疗的价值需结合肿瘤特征制定个体化方案。随着靶向治疗和免疫治疗的快速发展,越来越多的难治性病例获得长期生存机会。对于患者而言,保持规范随访、积极参与临床试验,将有助于在这场与罕见肿瘤的博弈中赢得主动。医学研究的每一次突破,都在为这类疾病的精准治疗绘制更清晰的蓝图,让我们在科学认知的基础上,以理性和希望面对挑战。
- 文章标题:组织细胞肉瘤恶性特征、遗传倾向与手术治疗深度解析
- 更新时间:2025-06-06 19:05:16

 400-029-0925
400-029-0925