当患者因不明原因的头痛、视力模糊或内分泌紊乱走进神经科诊室,影像学检查发现鞍区占位性病变时,医生往往需要在多种鞍区肿瘤中抽丝剥茧。其中,鞍区颗粒细胞瘤(Granular Cell Tumor of the Sellar Region)作为一种起源于神经胶质细胞的罕见病变,虽发病率仅占鞍区肿瘤的 0.1%-0.3%,但其独特的影像学表现与临床进程,常给精准诊断与治疗带来挑战。我们将从影像诊断的核心要点、术后复发的影响因素、治疗方案的费用构成等关键问题展开,结合最新临床研究,为医患双方提供系统化的诊疗参考。

一、鞍区颗粒细胞瘤影像表现:多模态影像学的精准识别
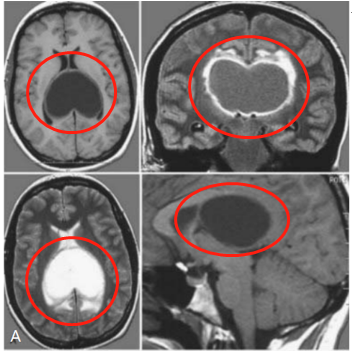
鞍区颗粒细胞瘤的影像学特征既具有神经胶质源性肿瘤的共性,又存在区别于垂体瘤、颅咽管瘤等常见鞍区病变的特异性表现,需通过 CT、MRI 及 PET-CT 等多模态检查进行综合判断。
(一)CT 检查的基础定位价值
在 CT 平扫图像中,肿瘤多表现为鞍内或鞍上稍高密度肿块,密度均匀者约占 70%,少数病例可见散在点状钙化(发生率约 15%-20%),钙化形态以砂砾样为主,区别于颅咽管瘤的弧形或蛋壳样钙化。肿瘤边界多清晰,呈类圆形或分叶状,直径通常在 1-3cm 之间,较大病灶(>3cm)可因占位效应导致鞍底骨质受压吸收,但极少出现骨质破坏,这与侵袭性垂体瘤的骨质侵蚀表现形成显著差异。增强扫描后,约 60%-70% 的肿瘤呈轻至中度均匀强化,强化程度低于垂体瘤的明显均匀强化,也不同于脑膜瘤的显著均匀强化。
(二)MRI 成像的特征性信号分析
1. T1 加权像信号特点
肿瘤在 T1WI 上多呈等信号或稍低信号,信号均匀性优于垂体瘤,仅 10%-15% 的病例因瘤内出血或脂质沉积出现局灶性高信号。当肿瘤累及下丘脑时,可见鞍上池填塞,视交叉受压上抬,与正常垂体组织(T1WI 呈等信号)的分界清晰,这得益于颗粒细胞瘤独特的细胞外基质成分 —— 富含嗜酸性颗粒的胞质在 MRI 上形成相对均质的信号背景。
2. T2 加权像及 Flair 序列表现
T2WI 上肿瘤多呈等或稍高信号,信号强度略低于脑脊液,高于脑白质。Flair 序列可抑制脑脊液信号,清晰显示肿瘤与周围神经结构的关系,约 80% 的病例可见视交叉前缘受压,而垂体柄移位方向取决于肿瘤生长部位:起源于鞍内者多导致垂体柄后移,鞍上起源者则引起垂体柄前倾。值得注意的是,肿瘤内罕见囊变坏死,这与垂体大腺瘤常见的囊变(发生率约 30%)形成重要鉴别点。
3. 动态增强扫描的强化模式
动态增强早期(0-1 分钟),肿瘤呈边缘性轻度强化,随后强化范围逐渐向中心扩展,至延迟期(5-10 分钟)达到峰值,表现为渐进性均匀强化。这种强化模式与颗粒细胞瘤富含毛细血管网但缺乏血窦结构的病理特点密切相关,区别于垂体瘤的快速均匀强化及脑膜瘤的 “脑膜尾征”。
(三)PET-CT 的代谢活性评估
18F-FDG PET-CT 检查显示,肿瘤代谢活性多与脑皮质相近或略高,SUVmax(标准化摄取值最大值)平均为 2.5-3.5.显著低于垂体瘤(SUVmax 多 > 4.0)及恶性肿瘤(SUVmax>5.0)。对于疑难病例,结合生长抑素受体显像(如 68Ga-DOTATATE PET-CT)可进一步鉴别:颗粒细胞瘤通常不表达生长抑素受体,而垂体瘤(尤其是泌乳素瘤、生长激素瘤)常呈阳性显像。
(四)与鞍区常见病变的鉴别诊断
|
鉴别疾病 |
关键影像特征 |
|
垂体腺瘤 |
垂体窝扩大,肿瘤与正常垂体分界不清,增强扫描早期显著强化,常伴激素分泌异常 |
|
颅咽管瘤 |
多伴囊变、钙化,钙化呈弧形或斑块状,T1WI 可呈高信号(胆固醇结晶) |
|
脑膜瘤 |
宽基底与鞍结节相连,增强扫描可见 “脑膜尾征”,MRI 信号均匀,T2WI 多呈等信号 |
|
生殖细胞瘤 |
好发于儿童及青少年,鞍上及松果体区多发病灶,AFP、HCG 可升高,增强扫描显著强化 |
二、鞍区颗粒细胞瘤复发规律:从病理机制到临床预测
鞍区颗粒细胞瘤虽属良性肿瘤(WHOⅠ 级),但约 20%-30% 的病例术后会出现复发,复发时间跨度较大,最短可在术后 6 个月内,最长可达 10 年以上,其复发机制与病理特征、手术切除程度及分子生物学特性密切相关。
(一)病理特征与复发的关联性
肿瘤细胞的组织学形态是预测复发的重要依据。显微镜下,颗粒细胞瘤由富含嗜酸性颗粒的大细胞组成,胞核小而圆,位于细胞中央或边缘。当出现以下病理特征时,复发风险显著升高:
细胞异型性:约 10% 的病例可见细胞核轻度增大、深染,核浆比增加,此类病例复发率较典型颗粒细胞瘤(无异型性)高 2-3 倍。
增殖活性升高:Ki-67 增殖指数 > 5% 的病例,术后 5 年复发率达 40%,而 Ki-67≤5% 者复发率仅 15%。这提示需通过免疫组化检测增殖活性,而非单纯依赖 HE 染色。

(二)手术切除程度的决定性作用
根据 Simpson 分级,手术切除程度分为五级:
- Ⅰ 级:肿瘤全切除(肉眼及镜下均无残留),5 年复发率 < 10%。
- Ⅱ 级:肉眼全切除,但硬脑膜附着处电灼处理,复发率约 15%-20%。
- Ⅲ 级:肉眼下部分切除,残留肿瘤直径 < 1cm,复发率升至 30%-40%。
- Ⅳ 级:残留肿瘤直径≥1cm 或多发残留,复发率高达 50%-60%。
值得注意的是,鞍区颗粒细胞瘤常与垂体柄、视交叉等重要结构粘连紧密,尤其当肿瘤起源于下丘脑底部时,强行全切除可能导致尿崩症、电解质紊乱等严重并发症。因此,对于位于关键功能区的肿瘤,部分医生倾向于选择次全切除(SimpsonⅢ 级),术后辅以放疗,以平衡复发风险与神经功能保护。
(三)分子生物学标记的预测价值
近年来研究发现,以下分子改变与复发相关:
BRAF V600E 突变:约 15% 的复发病例存在该突变,突变阳性者术后 3 年复发率达 50%,显著高于野生型病例(20%)。
PTEN 基因缺失:表现为肿瘤组织中 PTEN 蛋白表达缺失,与肿瘤侵袭性生长及复发密切相关,常见于多次复发的病例。
(四)复发的临床监测与干预时机
术后患者需定期进行影像学随访,推荐方案为:
- 术后 1-2 年:每 3-6 个月行鞍区 MRI 增强扫描。
- 术后 3-5 年:每 6-12 个月检查一次。
- 5 年以上:每年一次影像学评估。
当随访发现肿瘤体积增大(直径增加≥2mm)或出现新的神经功能缺损(如视力下降、垂体功能减退加重)时,需考虑复发可能。对于无症状的微小复发灶(直径 <1cm),可暂予观察;若病灶压迫重要结构或生长速度> 2mm / 年,则需积极干预,治疗方式包括二次手术、立体定向放疗(如伽马刀)或药物治疗(目前尚无特效药物,实验性靶向治疗正在探索中)。
三、鞍区颗粒细胞瘤治疗费用:多维度考量下的成本分析
鞍区颗粒细胞瘤的治疗费用因治疗方式、医院等级、地区差异及患者个体情况而有显著不同,总体可分为手术治疗、术后辅助治疗及长期随访管理三部分。
(一)手术治疗的费用构成
1. 术前评估费用(约 1-2 万元)
包括血常规、肝肾功能、凝血功能等基础检查(约 2000-3000 元),鞍区 MRI 增强扫描(800-1500 元)、CT 检查(300-500 元)、PET-CT(如需鉴别诊断,约 7000-10000 元),以及内分泌功能评估(如垂体激素六项、性激素水平检测,约 1500-2000 元)。对于合并视力障碍者,还需进行视野检查(约 500-800 元)和眼底照相(300-500 元)。
2. 手术费用(约 3-8 万元)
根据手术入路不同,费用存在差异:
经蝶窦微创手术:适用于局限于鞍内或向鞍上轻度生长的肿瘤,使用神经内镜或显微镜操作,费用约 3-5 万元,包括手术耗材(如神经内镜套件、可吸收硬脑膜补片)、麻醉费用(全身麻醉约 5000-8000 元)及住院费用(7-10 天,约 8000-12000 元)。
开颅手术:适用于肿瘤向鞍旁、颅前窝或颅后窝扩展的病例,常用额下入路或翼点入路,费用约 5-8 万元,主要增加项为开颅器械、颅骨固定材料(如钛钉钛板,约 1-2 万元)及较长的住院时间(10-14 天,住院费用 15000-20000 元)。
3. 术后早期治疗费用(约 1-3 万元)
包括术后监护(ICU 监护 1-2 天,约 5000-10000 元)、抗利尿激素替代治疗(如去氨加压素,根据尿崩症严重程度,约 2000-5000 元)、糖皮质激素替代(如泼尼松,费用较低,但需监测电解质及血糖,约 1000-2000 元),以及预防感染的抗生素(根据是否使用特殊抗生素,约 2000-8000 元)。

(二)术后辅助治疗费用
1. 放射治疗(约 2-5 万元)
对于次全切除(SimpsonⅢ-Ⅳ 级)或复发风险高的病例(如 Ki-67>5%、BRAF 突变阳性),需行术后放疗。
普通放疗:费用约 2-3 万元,适用于设备条件有限的医院,但精准度较低,可能增加垂体功能损伤风险。
立体定向放疗(伽马刀 / 射波刀):费用约 4-5 万元,具有定位精准、对周围组织损伤小的优势,尤其适合直径 < 3cm 的残留或复发灶。
2. 药物治疗(费用差异较大)
目前尚无获批的针对性药物,仅在复发或进展病例中尝试靶向治疗或化疗:
靶向治疗:如 BRAF 抑制剂(维莫非尼),每月费用约 2-3 万元,需持续服用至疾病进展,经济负担较重。
化疗:常用替莫唑胺,每月费用约 5000-8000 元,疗效尚不明确,仅作为姑息治疗选择。
(三)长期随访与并发症管理费用
1. 随访检查费用(每年约 5000-10000 元)
包括每年 1-2 次的 MRI 增强扫描(每次 800-1500 元)、垂体激素检测(约 1500 元 / 次)、视野检查(500 元 / 次)及血常规、肝肾功能等基础检查(约 1000 元 / 次)。
2. 并发症治疗费用
垂体功能减退:需长期激素替代治疗,如甲状腺素片(约 100 元 / 月)、泼尼松(约 50 元 / 月)、性激素(根据缺失类型,约 200-500 元 / 月),年费用约 3000-6000 元。
尿崩症:去氨加压素鼻喷雾剂(约 200 元 / 支,每月 1-2 支),年费用约 2400-4800 元。
视力损伤:部分患者需配镜或进行视力康复治疗,费用因具体情况而异。
(四)不同地区与医院等级的费用差异
一线城市三甲医院:总体治疗费用较二三线城市高 20%-30%,主要体现在手术耗材、护理费及特需服务费用。
医保报销情况:手术及放疗费用通常可报销 60%-80%(根据医保类型及当地政策),但靶向药物、进口耗材等自费项目比例较高,可能导致实际自付费用差异较大。
四、鞍区颗粒细胞瘤临床常见问题深度解析
1. 鞍区颗粒细胞瘤的典型临床症状有哪些?
肿瘤的临床表现取决于生长部位与占位效应:
内分泌症状:约 40%-50% 的患者出现垂体功能减退,表现为乏力、月经紊乱、性欲下降等,因肿瘤压迫垂体柄导致泌乳素轻度升高(“垂体柄效应”),但显著高泌乳素血症(>200ng/ml)罕见,需与泌乳素瘤鉴别。
神经压迫症状:最常见为视力视野障碍(约 60%-70%),典型表现为双颞侧偏盲,由视交叉受压所致;其次为头痛(约 50%),多因鞍隔受牵拉或脑积水引起;少数肿瘤侵犯下丘脑者可出现尿崩症(发生率约 10%-15%)、食欲异常或体温调节障碍。
2. 孕期发现鞍区颗粒细胞瘤该如何处理?
孕期鞍区肿瘤可能因激素变化出现体积增大,处理需兼顾母胎安全:
妊娠早期(<12 周):如无症状,建议密切观察,避免孕期前 3 个月进行 MRI 增强扫描(钆对比剂的安全性尚存争议)。
妊娠中晚期:若肿瘤压迫视交叉或引起严重头痛,可在神经外科与产科团队协作下,选择孕 24-32 周进行经蝶窦手术,优先保障母亲视力与生命安全。
产后管理:产后 6-12 周复查 MRI,根据肿瘤变化决定是否进一步治疗,哺乳期间需评估垂体功能,必要时进行激素替代。
3. 儿童鞍区颗粒细胞瘤有哪些特点?
儿童病例仅占所有鞍区颗粒细胞瘤的 5%-10%,临床表现与成人存在差异:
症状更隐匿:常以发育迟缓、性早熟为首发表现,因下丘脑 - 垂体轴受累更早,需与颅咽管瘤、生殖细胞瘤仔细鉴别。
影像学特征:肿瘤多呈囊性变(发生率约 30%),易误诊为颅咽管瘤,但囊液成分以蛋白液为主,而非胆固醇结晶,CT 钙化少见。
治疗策略:由于儿童对放疗的远期神经认知损伤风险较高,手术更倾向于争取全切除,术后密切随访,避免过早使用放疗。
4. 鞍区颗粒细胞瘤患者能否正常生育?
生育能力取决于肿瘤对垂体 - 性腺轴的影响及治疗方式:
术前评估:若存在垂体功能减退,需通过激素替代治疗恢复性腺功能,如补充雌孕激素或促性腺激素,部分患者可实现自然受孕。
手术影响:经蝶手术损伤垂体柄或垂体门脉系统可能导致术后泌乳素升高或性腺功能低下,约 20%-30% 的患者需辅助生殖技术(如试管婴儿)。
放疗影响:盆腔放疗会损害卵巢功能,但鞍区放疗对生育力影响较小,主要需关注垂体功能的长期维护。
5. 术后出现脑脊液鼻漏该如何处理?
脑脊液鼻漏是经蝶手术的严重并发症,发生率约 2%-5%,处理流程如下:
保守治疗:卧床休息、抬高床头 30°、避免用力擤鼻,同时使用抗生素预防颅内感染,约 50% 的小漏口可在 1-2 周内自行愈合。
手术修补:若保守治疗失败(持续漏液 > 72 小时或出现颅内感染),需行内镜下硬脑膜修补术,使用自体筋膜、脂肪或人工硬脑膜材料,成功率可达 90% 以上。
结语
鞍区颗粒细胞瘤的诊疗过程,恰似一场精密的拼图游戏 —— 从影像学的蛛丝马迹中捕捉肿瘤特征,在病理切片的细微差异里预判复发风险,于治疗方案的利弊权衡间寻求最佳平衡。随着神经影像技术的进步(如 7T MRI 的应用)、分子病理检测的普及(如二代测序技术)及精准治疗手段的发展(如针对 BRAF 突变的靶向药物),这种曾经的 “疑难肿瘤” 正逐渐褪去神秘面纱。对于患者而言,建立长期随访意识、保留完整的影像学与病理资料、积极参与多学科会诊,是应对疾病复发与并发症的关键;对于医者而言,持续更新对这种罕见病变的认知,在标准化诊疗框架下实施个体化方案,方能在守护鞍区这片 “神经内分泌枢纽” 的战场上,为患者争取最优预后。医学的温度,恰在于对每一种罕见的敬畏,对每一个个体的珍视,这或许正是破解鞍区颗粒细胞瘤诊疗难题的终极答案。
- 文章标题:鞍区颗粒细胞瘤影像表现?多久复发?治疗费用?
- 更新时间:2025-06-06 19:15:54

 400-029-0925
400-029-0925