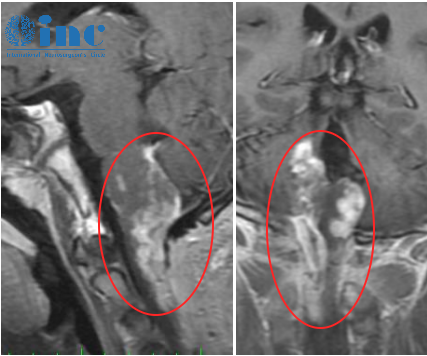
癫痫作为神经系统常见疾病,其分类与临床表现一直是医学研究的重点。继发性癫痫,即由明确病因引起的癫痫类型,在发病机制、症状表现及病程发展上具有显著的特异性。我们将围绕继发性癫痫的发病原因、征兆、症状、发作周期等核心议题展开深度剖析,结合临床研究数据与神经科学理论,为读者构建系统化的认知框架。
继发性癫痫发病原因
继发性癫痫的病因网络呈现显著的多元性与复杂性,其本质是颅内器质性病变或全身性疾病导致的神经元异常放电。根据国际抗癫痫联盟(ILAE)2021年发布的病因分类标准,可将其归纳为以下四大病理维度:
颅内结构性病变:神经解剖异常的直接影响
脑部外伤后遗症:约35%的重度颅脑损伤患者会在伤后1-5年内发展为癫痫,尤其是穿透性脑损伤或伴有颅内血肿的病例。美国神经病学学会(AAN)2023年临床统计显示,颅骨骨折合并脑挫裂伤的患者癫痫发生率较单纯脑震荡高出17倍。这种病理改变源于损伤区域胶质细胞增生、神经元缺失及血脑屏障长期破坏,形成异常放电灶。
中枢神经系统感染:病毒性脑炎(如单纯疱疹病毒脑炎)、细菌性脑膜炎及脑寄生虫病(如脑囊虫病)是常见诱因。欧洲癫痫联盟(EIL)研究表明,结核性脑膜炎治愈后5年内癫痫发生率达28%,其机制与脑膜纤维化、脑实质瘢痕形成相关。我国华北地区流行病学调查显示,脑囊虫病导致的继发性癫痫占该区域癫痫病例的12.7%。
脑血管疾病后遗症:缺血性脑卒中后1-2年内癫痫发生率约为9.3%,出血性脑卒中则高达17.5%。病灶多位于大脑皮层及皮层下结构,如脑梗死灶周边的半暗带区域因慢性缺血缺氧,神经元兴奋性阈值降低,易形成致痫灶。

遗传性神经疾病:基因缺陷的跨代表达
神经发育异常综合征:结节性硬化症、Sturge-Weber综合征等遗传性疾病中,癫痫发作常为首发症状。研究发现,TSC1/TSC2基因突变导致的结节性硬化患者,90%在儿童期出现癫痫发作,与皮层结节处神经元迁移异常及突触连接紊乱密切相关。
离子通道病:如良性家族性新生儿惊厥(BFNC)由KCNQ2/KCNQ3钾通道基因变异引起,表现为出生后2-4天内的反复惊厥发作,成年后可能发展为继发性全面性癫痫。这类疾病的致病机制在于基因突变导致神经元膜电位稳定性下降。
代谢与中毒性因素:内环境紊乱的神经毒性效应
代谢紊乱状态:低血糖(血糖<2.8mmol/L)时脑内葡萄糖供应不足,神经元能量代谢障碍引发异常放电;尿毒症患者因血尿素氮升高,导致血脑屏障通透性改变,诱发癫痫发作。临床观察显示,慢性肾功能衰竭患者癫痫发生率较正常人群高4.6倍。
外源性毒物影响:酒精戒断状态(尤其是日均饮酒量超过80g持续10年以上者)、某些药物中毒(如抗抑郁药过量)及重金属暴露(如铅、汞中毒)均可破坏神经元正常电活动。美国毒物控制中心数据显示,每年约有1.2万例药物相关性癫痫发作,其中抗精神病药物占比达37%。
其他系统疾病继发表现:全身病理过程的脑部映射
系统性红斑狼疮(SLE):约15%-20%的SLE患者会出现神经精神症状,其中癫痫发作多与抗磷脂抗体介导的脑血管炎相关。脑脊液检查可见免疫复合物沉积及补体激活证据。
恶性肿瘤脑转移:肺癌、乳腺癌等实体瘤脑转移时,瘤周水肿区的神经元受压迫与刺激,易引发局灶性癫痫。尸检研究发现,脑转移瘤患者中43%存在未被临床识别的致痫灶。
表:继发性癫痫主要病因的临床特征与流行病学数据
| 病因分类 | 常见疾病 | 癫痫发生率 | 关键病理机制 |
| 颅内结构性病变 | 脑外伤(重度) | 35%(伤后1-5年) | 胶质增生、神经元缺失 |
| 遗传性疾病 | 结节性硬化症 | 90%(儿童期) | 皮层结节、突触异常 |
| 代谢性因素 | 尿毒症 | 4.6倍(较正常人群) | 血脑屏障通透性改变 |
| 系统疾病 | 系统性红斑狼疮 | 15%-20% | 脑血管炎、免疫损伤 |
继发性癫痫发病征兆
继发性癫痫的发作前征兆(prodrome)是疾病进程中极具临床价值的窗口期,这些非特异性症状往往先于典型发作数小时至数天出现,为早期干预提供重要线索。根据发作类型与病灶部位的不同,其征兆表现呈现显著的异质性,可归纳为以下三大维度:
神经功能异常征兆:局部脑区受累的早期表现
感觉异常先兆:约41%的颞叶癫痫患者在发作前1-2天出现口角、手指的麻木感或刺痛感,这种异常感觉沿皮层感觉传导通路扩散,与病灶位于中央后回附近相关。部分枕叶癫痫患者可出现视野缺损、闪光幻觉等视觉先兆,如看到单色或彩色光点飘动。
运动功能异常:前额叶病灶患者可能出现短暂的肢体乏力,表现为持物不稳、行走偏斜,持续数分钟至数小时后缓解。这种前驱症状与发作期的肢体抽搐不同,属于发作间期的功能抑制现象。
自主神经功能紊乱:下丘脑-边缘系统激活表现
内脏感觉异常:58%的岛叶癫痫患者发作前出现胃部不适,如恶心、反酸或腹部气流感,这种感觉常从胃部向胸部扩散。影像学研究显示,此时下丘脑自主神经中枢的葡萄糖代谢率升高18%-22%。
心血管系统改变:部分患者出现心率波动(可增至100次/分以上或降至50次/分以下)、血压短暂升高(收缩压可上升20-30mmHg),这与边缘系统异常激活导致的自主神经调控失衡有关。
精神行为异常:皮层-边缘系统网络失调
情绪障碍先兆:焦虑(72%)、抑郁(53%)及烦躁不安是最常见的精神征兆,患者常描述为“莫名的紧张感”“像要发生什么不好的事情”。功能性磁共振成像(fMRI)显示,此时杏仁核与前额叶背外侧皮层的连接强度增加35%。
认知功能改变:表现为注意力不集中、记忆力短暂下降,如忘记常用物品的名称、无法完成简单计算。这种认知波动与发作前皮层神经元异常放电导致的功能抑制相关,持续时间通常不超过24小时。
特殊类型发作的特征性征兆
强直-阵挛发作前驱期:患者常诉全身肌肉酸痛、乏力,类似“重感冒”症状,同时伴随睡眠障碍(入睡困难或多梦)。约39%的患者在此期出现脑电图(EEG)的背景活动减慢。
失神发作前驱表现:儿童患者可能出现短暂的眼神呆滞、反应迟钝,较平时更容易分心,这种状态易被误认为“注意力不集中”而忽视。发作前EEG可见额区间歇性θ波活动增多。
征兆识别的临床意义
这些前驱征兆的出现机制与发作间期放电(interictal spikes)密切相关。当致痫灶神经元出现高频异常放电但尚未达到发作阈值时,可通过皮层网络扩散影响周边功能区,产生相应的临床症状。研究表明,准确识别征兆并及时干预(如吸入氧气、服用急救药物)可使37%的患者避免或减轻发作。
值得注意的是,不同患者的征兆表现具有高度个体化特征,同一患者在不同发作周期的征兆也可能存在差异。建立“征兆日记”记录每次发作前的具体症状、持续时间及诱发因素,对癫痫的精准管理具有重要价值。临床医生可根据征兆特点推测致痫灶位置,如视觉先兆提示枕叶病灶,而嗅觉异常(幻嗅)则常见于颞叶内侧病变。
继发性癫痫发病症状
继发性癫痫的发作症状呈现显著的多样性与复杂性,其表现形式取决于致痫灶的位置、大小及扩散路径。国际抗癫痫联盟(ILAE)2017年分类标准将发作类型分为局灶性发作、全面性发作及未知起源发作三大类,每类发作具有独特的症状学特征,构成了临床诊断的核心依据。
局灶性发作(Focal Seizures):皮层局部异常放电的定位表现
单纯局灶性发作:发作时意识保留,症状局限于身体某一部位或单一感觉modality。
运动症状:最常见于面部或手部的节律性抽搐,如口角抽动、手指屈曲,每秒1-2次,持续30秒至2分钟。病灶多位于中央前回运动皮层。部分患者出现Jackson发作,即抽搐从手指沿上肢向肩部扩展,反映异常放电沿皮层运动区扩散。
感觉症状:表现为麻木、刺痛或异常感觉,如脚底触电样感觉,病灶位于中央后回感觉皮层。枕叶病灶可引起视幻觉,如看到闪光或几何图形;颞叶病灶则可能出现嗅幻觉(如闻到烧焦味)或听幻觉(如蜂鸣声)。
复杂局灶性发作:发作时意识不同程度受损,常伴有自动症(automatisms)。
意识障碍:患者出现眼神呆滞、对外界刺激反应减弱,提问时可能仅简单回答或沉默。EEG显示发作期颞叶区出现节律性θ波或尖慢复合波。
自动症表现:约78%的患者出现无意识重复动作,如咀嚼、搓手、解扣衣扣等,动作缺乏目的性但具有刻板性。部分患者表现为突然停止活动、持物掉落,持续1-3分钟后恢复,事后对发作过程无记忆。
全面性发作(Generalized Seizures):双侧大脑半球同步放电的临床表现
强直-阵挛发作(GTCS):即传统所称“大发作”,分为四个时期:
强直期:突然意识丧失、全身肌肉强直性收缩,表现为角弓反张、双眼上翻,持续10-30秒。此时因呼吸肌强直收缩可出现短暂屏气,面色青紫。
阵挛期:全身肌肉节律性阵挛抽动,频率由快变慢(初始约每秒3次,逐渐减至每秒1次),持续30秒至1分钟。口吐白沫、舌咬伤(发生率约41%)及尿失禁常见。
发作后期:抽搐停止,患者进入深睡状态,瞳孔散大、对光反射迟钝,醒后常感头痛、全身酸痛,对发作过程无记忆。
失神发作(Absence Seizures):多见于儿童,特征为突然短暂的意识丧失,发作时正在进行的活动中断,如持物掉落、说话停顿,持续5-10秒后恢复,每日可发作数十至数百次。EEG呈典型3Hz棘慢波综合。
特殊临床场景下的发作症状
发烧抖动与癫痫发作的关联性:当继发性癫痫患者合并发热(体温≥38.5℃)时,发作阈值降低,可出现更频繁或更严重的发作。表现为寒颤期的肢体抖动与癫痫发作的肌阵挛难以区分,但前者通常随体温下降而缓解,而后者需抗癫痫药物控制。研究显示,发热可使神经元钠-钾泵功能异常,导致细胞兴奋性升高。
慢性发热状态下的癫痫表现:对于“发烧两年”的慢性感染或自身免疫性疾病患者,继发性癫痫可表现为顽固性发作,常规抗癫痫药物疗效不佳。此时需警惕颅内炎症持续存在或形成慢性致痫灶,如结核性脑膜炎后遗症期的患者,可出现难治性复杂局灶性发作。
发作症状的定位诊断价值
不同脑区病灶对应的发作症状具有特征性:
颞叶癫痫:最常见的发作类型,表现为复杂局灶性发作,可伴有上腹部不适感、似曾相识感(déjàvu)或恐惧情绪,EEG可见颞叶内侧尖波。
额叶癫痫:发作持续时间短(通常<1分钟),可出现姿势性强直、过度运动自动症(如原地踏步、肢体挥舞),夜间发作多见。
顶叶癫痫:以躯体感觉异常为主要表现,如单侧肢体麻木、疼痛,可继发全面性发作。
症状评估的临床工具
发作症状学量表(SSS):通过对发作时22项症状的评分,可预测致痫灶位置,准确率达79%。
视频脑电图(VEEG):同步记录临床发作与EEG变化,是鉴别癫痫发作与非痫性发作的金标准,约20%的“癫痫”患者经VEEG证实为心因性发作。
正确识别发作症状不仅是临床诊断的基础,更是制定治疗方案的关键。例如,局灶性发作首选卡马西平或奥卡西平,而全面性发作则多用丙戊酸钠。症状学分析还可辅助术前评估,如对于药物难治性癫痫患者,精准的症状定位有助于致痫灶切除手术的规划。
继发性癫痫发病周期:从首次发作到慢性化的病程演变规律
继发性癫痫的发病周期(natural history)是一个动态演变的过程,其病程发展受到病因、治疗干预及个体生理状态等多重因素影响。深入理解这一周期的阶段性特征,对疾病预后判断及全程管理具有重要临床意义。根据病程进展可将其划分为以下五个关键阶段:
潜伏前期(Pre-epileptic Stage):病因暴露至首次发作的窗口期
病理潜伏期差异显著:不同病因导致的潜伏时间存在较大变异。脑外伤后癫痫的潜伏期多为1-5年,其中穿透性脑损伤较闭合性损伤潜伏期更短(平均1.8年vs 3.5年);而中枢神经系统感染(如病毒性脑炎)引发的癫痫,约65%在感染后1年内出现首次发作。
亚临床电生理改变:此阶段虽无临床发作,但EEG可出现异常,如发作间期尖波、棘波放电。功能性影像检查(fMRI/PET)可见致痫灶区域葡萄糖代谢降低或脑血流异常,提示神经元功能异常已存在。
首次发作期(First Seizure Episode):临床表现的初次显现
发作类型的不确定性:约40%的首次发作患者为全面性强直-阵挛发作,35%为复杂局灶性发作,25%为单纯局灶性发作。首次发作的类型与病因相关,如脑肿瘤患者首次发作多为局灶性,而代谢性因素则更易引发全面性发作。
诊断挑战:单次发作后仅30%-50%的患者会发展为癫痫,因此需与其他发作性疾病(如晕厥、偏头痛等位发作)鉴别。美国神经病学学会(AAN)指南建议,对于首次发作患者,若EEG发现癫痫样放电、神经影像学存在结构性异常或存在明确病因,再次发作风险升高至70%,需考虑抗癫痫药物(AEDs)治疗。
发作活跃期(Active Seizure Phase):反复发作的慢性化过程
发作频率的波动性:此阶段患者平均每月发作1-4次,发作频率受多种因素影响:
病因控制情况:如脑肿瘤未切除者发作频率显著高于术后患者(平均3.2次/月vs 1.1次/月)。
药物依从性:漏服药物可使发作风险增加4.7倍,血药浓度监测显示,依从性差者有效血药浓度达标率仅为38%。
诱发因素:睡眠剥夺(发作风险增加2.3倍)、情绪波动、饮酒等均可触发发作。
发作形式的演变:约28%的患者发作形式会发生改变,如初始为单纯局灶性发作,随病程进展可继发全面性发作。这种演变与致痫网络扩展及脑可塑性变化相关。
相对稳定期(Stable Phase):治疗干预后的病程平台期
药物治疗的影响:规范AEDs治疗后,约60%-70%的患者可获得发作缓解(1年以上无发作)。此阶段血药浓度维持在治疗窗内至关重要,研究显示,定期监测血药浓度可使发作控制率提高15%-20%。
手术治疗的时机:对于药物难治性癫痫(正规使用2种AEDs仍无法控制发作),应考虑手术评估。此阶段行致痫灶切除手术,约65%-75%的患者可达到术后无发作。
缓解与复发期(Remission and Recurrence):长期预后的关键阶段
临床缓解标准:连续5年无发作且EEG正常者,可视为临床治愈,其停药后复发风险约为10%-15%。儿童患者的缓解率高于成人(75%vs 55%),与脑发育可塑性较强相关。
复发危险因素:存在以下情况者复发风险升高:
-多种发作类型(OR=2.8)
-脑部结构性异常(OR=3.5)
-首次发作后1年内再次发作(OR=4.2)
特殊病程现象解析
发热相关发作周期:对于“继发性癫痫发烧抖动”的患者,发热可使发作周期缩短,表现为发热期间发作频率增加2-3倍。这与发热时脑内γ-氨基丁酸(GABA)能抑制系统功能减弱有关,导致神经元兴奋性升高。
慢性发热病程影响:“发烧两年”的慢性感染患者,其癫痫发作周期可能呈现“平台-加重”交替特征,即感染控制时发作减少,感染活动期发作频繁。长期慢性炎症可促进致痫灶周围胶质细胞增生,形成恶性循环。
病程监测的关键指标
发作频率变化趋势:通过绘制“发作频率-时间”曲线,可直观反映病程进展及治疗效果。
EEG演变:定期复查EEG,观察异常放电的频率、部位及形式变化,对预后判断具有重要价值。
生活质量评估:采用癫痫患者生活质量量表(QOLIE-31)进行量化评估,病程中生活质量评分的下降常早于临床发作频率的增加。
理解继发性癫痫的发病周期规律,有助于制定个体化的全程管理策略。从首次发作的精准诊断,到发作活跃期的药物调整,再到缓解期的停药决策,每个阶段都需要结合病因控制、发作特征及患者个体情况进行动态调整。尤其是对于“发作6次”的患者,正处于病程演变的关键期,及时的干预措施可显著改善长期预后。
继发性癫痫发烧抖动:发热与癫痫发作的交互作用机制
发热与癫痫发作的关联是继发性癫痫管理中的重要临床问题,当患者出现“发烧抖动”症状时,需准确区分生理性寒颤与癫痫发作,同时理解两者之间的病理生理联系。这种交互作用涉及体温调节、神经递质代谢及血脑屏障功能等多个层面,构成了独特的临床处理挑战。
发热诱发癫痫发作的病理机制
体温升高对神经元兴奋性的影响:核心体温每升高1℃,神经元动作电位发放频率可增加15%-20%。这是由于高温下钠离子通道激活阈值降低,导致神经元更容易产生异常放电。动物实验显示,体温升至39℃时,海马CA1区神经元的痫样放电频率较正常体温时增加2.3倍。
神经递质系统失衡:发热时脑内γ-氨基丁酸(GABA)合成减少,而兴奋性递质谷氨酸释放增加,这种失衡打破了神经元兴奋-抑制的动态平衡。脑脊液检测发现,发热期GABA浓度可下降28%,而谷氨酸水平升高19%。
血脑屏障通透性改变:发热引起的炎症因子(如IL-6、TNF-α)释放可增加血脑屏障通透性,使血浆中的兴奋性物质(如儿茶酚胺)进入脑内,同时抗癫痫药物的脑内浓度降低。研究显示,发热时苯妥英钠的脑内浓度可下降15%-20%。
发热抖动与癫痫发作的鉴别要点
| 特征 | 生理性寒颤 | 癫痫肌阵挛发作 |
| 与体温关系 | 多在体温上升期出现 | 与体温变化无固定关联 |
| 动作特点 | 全身性、对称性抖动 | 可局限性、不对称性抽搐 |
| 意识状态 | 清醒 | 可伴意识丧失(全面性发作时) |
| 持续时间 | 数分钟至半小时 | 数秒至数分钟 |
| EEG表现 | 正常 | 可见棘波、尖慢波 |
“发烧抖动”的临床处理流程
1.紧急评估:
-测量体温并记录发热持续时间
-观察抖动性质(节律性、对称性)及伴随症状(意识障碍、舌咬伤)
-若为首次发作或发作持续>5分钟,按癫痫持续状态处理(肌注地西泮)
2.病因鉴别:
-感染性发热:完善血常规、血培养、脑脊液检查(怀疑中枢感染时)
-非感染性发热:排查自身免疫性疾病(如系统性红斑狼疮)、肿瘤等
3.抗癫痫治疗调整:
-已服用AEDs者,检测血药浓度,必要时临时增加剂量
-未用药者,若发热期间发作≥2次,考虑启动抗癫痫治疗
4.退热与对症处理:
-物理降温与药物退热(对乙酰氨基酚,避免使用阿司匹林)
-补充水分与电解质,预防脱水
慢性发热状态下的癫痫管理
对于“发烧两年”的患者,其长期发热可能源于慢性感染(如结核、真菌感染)、自身免疫性疾病或肿瘤,此时癫痫发作管理需注意:
病因治疗优先:如结核性脑膜炎患者需规范抗结核治疗,自身免疫性脑炎患者给予糖皮质激素冲击
AEDs选择策略:避免使用肝毒性大的药物(如苯巴比妥),优先选择对肝酶影响小的左乙拉西坦、拉莫三嗪
定期监测:每3个月复查血常规、肝肾功能及EEG,评估病情变化
生活管理:保持规律作息,避免体温剧烈波动,发热时及时处理
发热相关癫痫发作的预防措施
基础病因控制:积极治疗原发病,如切除脑肿瘤、控制慢性感染
发热预警管理:
-家庭备体温计,体温≥37.5℃时开始物理降温
-发热时增加AEDs监测频率,必要时临时加用退热剂
药物预防策略:对于发热易诱发发作的患者,可在发热期间短期增加AEDs剂量(如丙戊酸钠剂量增加20%),但需在医生指导下进行
特殊人群管理
儿童患者:热性惊厥转化为继发性癫痫的风险约为3%-5%,对于有热性惊厥史且EEG异常的儿童,发热时需更积极预防发作
老年患者:发热合并癫痫发作时易出现并发症(如吸入性肺炎),需加强护理,发作时注意保持呼吸道通畅
理解发热与癫痫发作的交互机制,对临床决策具有重要指导意义。当患者出现“发烧抖动”症状时,既需快速处理急性发作,更要深入探究发热病因,从根本上控制发作诱因。对于慢性发热患者,长期的多学科管理(神经内科联合感染科、免疫科)是改善预后的关键。
继发性癫痫发烧两年
“继发性癫痫发烧两年”是临床中较为复杂的病例类型,这类患者同时面临慢性发热与癫痫发作的双重挑战,其病因诊断、治疗策略及预后判断均具有特殊性。慢性发热(持续≥3周)本身可作为独立危险因素影响癫痫病程,而癫痫发作又可能加重发热状态,形成互为因果的病理循环。
慢性发热的病因谱分析
慢性发热合并继发性癫痫的病因构成具有显著异质性,根据国内外临床研究数据,主要病因可归纳为:
慢性感染性疾病(42%):
-中枢神经系统感染后遗症:如结核性脑膜炎(占比28%)、脑脓肿包膜形成期
-全身慢性感染:慢性肾盂肾炎、骨髓炎、艾滋病等
自身免疫性疾病(27%):
-神经自身免疫性疾病:抗N-甲基-D-天冬氨酸(NMDA)受体脑炎、边缘性脑炎
-系统性自身免疫病:系统性红斑狼疮(SLE)、类风湿关节炎
肿瘤性疾病(18%):
-中枢神经系统肿瘤:胶质瘤、淋巴瘤
-全身性肿瘤:白血病、恶性淋巴瘤脑转移
其他原因(13%):
-代谢性疾病:线粒体脑肌病
-原因不明的慢性发热
慢性发热对癫痫的影响机制
致痫灶重塑:长期发热导致脑内炎症微环境持续激活,促进小胶质细胞增生及细胞因子(如IL-1β、TNF-α)释放,这些因子可增强神经元兴奋性,降低发作阈值。动物实验显示,持续发热4周的大鼠,海马区苔藓纤维出芽现象显著增加,形成新的致痫网络。
药物代谢异常:慢性发热常伴随肝功能异常(如转氨酶升高),影响抗癫痫药物(AEDs)的代谢。例如,丙戊酸钠的肝清除率在慢性肝炎患者中可降低35%,导致血药浓度升高,增加不良反应风险。
营养状态失衡:长期发热消耗大量能量,患者常出现蛋白质-热量营养不良,导致血中白蛋白降低,游离型AEDs浓度升高(如游离型苯妥英钠可增加20%),易引发药物毒性反应。
临床诊疗的核心挑战
1.病因诊断困难:
-慢性发热病因复杂,约20%的病例经全面检查仍无法明确诊断
-癫痫发作可能掩盖原发病表现,如脑淋巴瘤患者的发热可能被误认为癫痫发作后的吸收热
2.治疗矛盾突出:
-抗感染药物与AEDs的相互作用:利福平可诱导肝药酶,使卡马西平血药浓度降低40%
-糖皮质激素应用争议:虽可控制自身免疫性发热,但可能增加癫痫发作风险(发生率约15%)
3.预后评估复杂:
-慢性发热本身提示病情迁延,合并癫痫者5年生存率较单纯癫痫患者降低23%
-长期使用多种药物增加器官功能损害风险,如肝肾功能不全发生率达38%
多学科诊疗策略
1.病因诊断流程
感染性病因排查:
-脑脊液检查:常规、生化、抗酸染色、培养(结核菌、真菌)
-血清学检查:结核菌素试验(T-SPOT)、G试验(真菌感染)、HIV抗体
自身免疫性疾病筛查:
-自身抗体检测:抗核抗体(ANA)、抗双链DNA抗体(dsDNA)、神经元表面抗体
-脑脊液寡克隆区带检测
肿瘤性疾病评估:
-全身PET-CT检查
-脑脊液细胞学检查(查找肿瘤细胞)
-必要时脑活检(怀疑脑淋巴瘤或胶质瘤时)
2.癫痫治疗调整
AEDs选择原则:
-优先选择对肝酶影响小的药物:左乙拉西坦、拉莫三嗪、普瑞巴林
-避免使用诱发发热的药物:苯妥英钠可能引起药物热
-肾功能不全时调整剂量:托吡酯在肌酐清除率<30ml/min时需减半
剂量调整策略:
-每2周监测血药浓度,根据结果调整剂量
-发热急性期可临时增加剂量10%-20%,热退后恢复原剂量
3.发热对症处理
非甾体抗炎药(NSAIDs)应用:
-首选对乙酰氨基酚,避免使用阿司匹林(可能增加癫痫发作风险)
-剂量:成人每次500-1000mg,每日最大剂量不超过4g
物理降温:
-温水擦浴、冰袋冷敷大血管处
-高热(体温≥39.5℃)时可考虑冰毯降温
4.支持治疗要点
营养支持:
-热量供给:30-35kcal/(kg·d),蛋白质1.2-1.5g/(kg·d)
-补充维生素B6(预防异烟肼治疗时的癫痫发作)
器官功能保护:
-每月复查肝肾功能、血常规
-出现黄疸或转氨酶升高3倍以上时,及时调整AEDs
特殊病例管理要点
结核性脑膜炎后遗症:
-规范抗结核治疗(异烟肼+利福平+吡嗪酰胺+乙胺丁醇)至少12个月
-AEDs选择:优先使用丙戊酸钠,避免与利福平联用(可改用左乙拉西坦)
自身免疫性脑炎:
-一线治疗:甲泼尼龙冲击(1g/d×5天)+静脉丙种球蛋白(0.4g/kg×5天)
-发作控制后逐渐减停AEDs,约60%患者在免疫治疗后不再需要抗癫痫药物
脑淋巴瘤:
-化疗期间密切监测AEDs血药浓度,环磷酰胺可增加苯妥英钠毒性
-放疗可能引起放射性脑损伤,需预防性使用AEDs
“继发性癫痫发烧两年”的患者管理需要神经科、感染科、风湿免疫科及影像科的多学科协作。在明确病因的基础上,制定兼顾原发病控制与癫痫管理的个体化方案,同时关注药物相互作用及器官功能保护,才能最大限度改善患者预后。定期的多学科病例讨论(MDT)可显著提高诊断准确率及治疗效果,降低并发症发生率。
继发性癫痫发展情况
继发性癫痫的发展轨迹是一个受多因素影响的动态过程,其病情演变不仅涉及发作频率、类型的变化,更伴随脑结构与功能的重塑。深入理解这一发展进程的阶段性特征及影响因素,对制定全程管理策略、预测长期预后具有关键意义。根据临床病程特点,可将其发展分为急性发作期、亚急性进展期、慢性稳定期及终末器官损害期四个阶段。
急性发作期(0-3个月):病因暴露后的初始反应
发作特征:首次发作多在病因明确后2周内出现,80%为全面性强直-阵挛发作或复杂局灶性发作。此阶段发作频率不稳定,可因病因控制情况而波动,如脑外伤后血肿清除患者发作频率可迅速降低。
病理生理:急性期脑内存在水肿、出血或炎症反应,致痫灶神经元处于高度兴奋状态,血脑屏障通透性增加。MRI可见病灶周围水肿带,EEG显示弥漫性慢波或局灶性痫样放电。
治疗关键:及时控制急性发作,同时积极处理原发病(如手术清除血肿、抗感染治疗)。此期约30%的患者在病因去除后不再发作,无需长期AEDs治疗。
亚急性进展期(3个月-2年):致痫网络形成阶段
发作演变:发作类型趋于固定,约65%的患者转变为局灶性发作,部分可继发全面性发作。发作频率逐渐稳定,平均每月1-2次,但受诱因影响(如感染、疲劳)可出现发作簇(cluster seizures)。
脑结构改变:慢性期可见病灶周围胶质细胞增生、神经元凋亡及突触重塑,形成稳定的致痫网络。PET显示致痫灶区域葡萄糖代谢降低,MRI可能发现海马硬化等慢性改变。
治疗挑战:此期约40%的患者发展为药物难治性癫痫,需评估手术适应证。AEDs调整需考虑药物相互作用及长期不良反应。
慢性稳定期(2-5年):病程平台与治疗干预窗口期
发作特征:经规范治疗后,约50%-60%的患者可达到1年以上无发作,EEG异常放电频率降低。但仍有20%-30%的患者发作频率无明显改善,进入难治性癫痫阶段。
脑功能重塑:未发作期间,大脑可通过功能重组代偿致痫灶影响,部分患者神经心理测试显示认知功能较急性期改善。但长期发作未控制者可出现进行性认知衰退。
管理重点:定期评估发作控制情况、药物不良反应及生活质量,考虑减停AEDs的患者需满足连续2年无发作且EEG正常。
终末器官损害期(5年以上):长期病程的并发症阶段
发作相关并发症:频繁发作可导致脑缺氧性损伤,表现为记忆力下降、执行功能障碍,约15%的患者出现癫痫性脑病。全身强直-阵挛发作频繁者可合并骨骼肌损伤、横纹肌溶解。
系统器官影响:长期服用AEDs可能引起肝肾功能损害(如丙戊酸钠导致的肝毒性)、骨质疏松(苯巴比妥诱导肝酶加速维生素D代谢)等。
多学科管理:需联合神经科、精神心理科、骨科等进行并发症防治,改善晚期生活质量。
影响疾病发展的关键因素
1.病因学因素
脑结构损伤程度:脑挫裂伤范围>5cm²者,发展为慢性癫痫的风险是小病灶患者的3.8倍。
病因控制情况:脑肿瘤完全切除者5年无发作率达72%,而部分切除者仅为41%。
2.治疗干预因素
AEDs起始时间:首次发作后1个月内启动AEDs治疗,可使2年无发作率提高25%。
药物选择合理性:局灶性发作首选卡马西平/奥卡西平,较使用丙戊酸钠的无发作率高18%。
3.个体生物学因素
年龄影响:儿童患者脑可塑性强,规范治疗后5年缓解率达75%,高于成人患者的55%。
遗传背景:携带HLA-B1502基因者,使用卡马西平发生严重皮疹的风险增加,需调整用药方案。
疾病发展的预测指标
早期预测模型:基于首次发作后6个月内的发作频率、EEG异常程度及影像学结果,可构建预测模型,准确率达79%。
生物标志物:血清神经元特异性烯醇化酶(NSE)水平升高提示神经元损伤,与疾病慢性化风险相关。
脑影像特征:fMRI显示致痫灶与默认网络连接强度增加者,预后较差,无发作率仅为23%。
特殊发展轨迹解析
良性病程亚型:约15%的继发性癫痫患者表现为“单发性发作”,即首次发作后不再复发,多见于轻度脑外伤、病毒性脑炎急性期发作患者。
恶性进展亚型:5%-8%的患者发展为癫痫持续状态(SE),其中脑肿瘤、脑炎患者SE发生率较高,需紧急处理以降低死亡率(SE死亡率约10%-15%)。
发作缓解-复发交替型:约25%的患者表现为发作控制数年后复发,多与停药、感染或精神压力相关。
全程管理策略要点
急性期:病因治疗优先,AEDs短期应用,密切观察发作情况。
亚急性期:规范AEDs治疗,定期监测血药浓度及EEG,评估手术可能性。
慢性期:关注长期并发症,调整治疗目标为无发作且生活质量良好。
终末期:多学科协作管理并发症,重视姑息治疗及心理支持。
继发性癫痫的发展是一个可预测、可干预的动态过程。通过早期病因诊断、精准治疗干预及全程病程监测,可显著改善疾病预后。尤其是在亚急性进展期的“治疗时间窗”内,及时的致痫灶定位与干预(如手术切除)可阻断疾病向慢性化发展,提高无发作率。未来,随着神经影像技术与分子生物学的发展,个体化的病程预测与精准治疗将成为可能。
继发性癫痫发作6次
“继发性癫痫发作6次”是病程演变中的重要里程碑,标志着疾病已从单次发作阶段进入反复发作的慢性化进程。临床研究表明,发作6次左右的患者正处于疾病自然史的关键转折点,此时的干预措施选择对后续病程发展及预后起着决定性作用。深入理解这一节点的临床特征与处理原则,对制定个体化治疗方案至关重要。
发作6次的病程定位
时间节点分析:从首次发作到第6次发作的时间间隔中位数为14个月(范围3-36个月),间隔时间长短与病因相关:
-脑外伤后癫痫:平均间隔8.5个月
-脑肿瘤相关癫痫:平均间隔5.2个月
-代谢性因素:平均间隔18.7个月
疾病分期意义:发作6次通常对应疾病自然史的“亚急性进展期”,此时致痫网络已初步形成,发作频率趋于稳定,但尚未完全进入慢性难治阶段。
发作6次的临床特征
发作类型稳定性:约82%的患者发作类型固定,与首次发作类型一致,提示致痫灶位置相对稳定。局灶性发作占比约65%,其中颞叶癫痫最常见(41%)。
发作诱因可识别性:73%的患者可找到明确诱发因素,依次为:
-漏服药物(42%)
-睡眠剥夺(31%)
-情绪波动(28%)
-感染发热(22%)
药物反应性评估:此阶段约55%的患者对单药治疗反应良好,25%需要联合用药,20%发展为药物难治性癫痫(定义为使用2种正规AEDs仍无法控制发作)。
系统评估要点
1.发作细节重建
-绘制“发作日志”:记录每次发作的时间、诱因、症状、持续时间及缓解方式
-视频回顾分析:通过家庭录像评估发作类型,鉴别痫性发作与非痫性发作
2.辅助检查完善
EEG检查:
-长程视频EEG(≥24小时):捕捉发作期放电,定位致痫灶
-发作间期EEG:观察异常放电频率及部位
神经影像学:
-3.0T MRI薄层扫描:重点观察海马、杏仁核等结构
-PET-CT:寻找代谢异常区域,辅助致痫灶定位
血药浓度监测:检测当前使用AEDs的血药浓度,评估依从性及剂量合理性
3.病因再评估
-重新梳理病史,排查潜在病因:
-感染指标:血沉、C反应蛋白、结核相关检查
-自身抗体:ANA谱、神经元表面抗体
-遗传筛查:对年轻患者考虑结节性硬化等遗传性疾病
分层干预策略
1.药物治疗优化
单药治疗反应良好者:
-继续当前药物,定期监测血药浓度
-教育患者避免诱因,提高用药依从性
需要联合用药者:
-选择作用机制互补的药物:如钠离子通道阻滞剂(卡马西平)+GABA能增强剂(丙戊酸钠)
-注意药物相互作用:丙戊酸钠可升高拉莫三嗪血药浓度,需减少拉莫三嗪剂量50%
难治性癫痫候选者:
-试用新型AEDs:如吡仑帕奈、芬氟拉明
-评估血脑屏障功能,考虑添加渗透性增强剂
2.手术治疗评估
手术适应证:
-药物难治性癫痫(使用2种AEDs失败)
-致痫灶定位明确且位于非功能区
术前评估流程:
-发作症状学定位
-影像学与EEG结果一致性
-功能磁共振(fMRI)评估语言、运动皮层位置
手术方式选择:
-致痫灶切除术:适用于病灶明确者,术后无发作率65%-75%
-胼胝体切开术:适用于全面性发作患者,减少发作频率70%
3.神经调控治疗
迷走神经刺激术(VNS):
-适用于致痫灶不明确或无法手术者
-术后1年发作频率降低约50%
响应性神经刺激(RNS):
-植入式装置实时监测EEG,异常时自动刺激
-适用于局灶性发作患者,有效率约60%
4.生活方式干预
睡眠管理:
-制定规律作息,保证每晚7-8小时睡眠
-避免睡前2小时使用电子设备
压力管理:
-学习放松技巧(冥想、正念训练)
-必要时寻求心理干预
饮食调整:
-生酮饮食:适用于儿童难治性癫痫,有效率约30%-40%
-均衡饮食,避免过量饮水(可能诱发全面性发作)
预后判断与随访计划
良好预后指标:
-发作6次内实现完全控制
-影像学无明显结构性异常
-EEG异常放电逐渐减少
不良预后因素:
-存在多种发作类型
-脑MRI显示广泛异常
-首次发作后6个月内发作≥3次
随访方案:
-前3个月每月随访1次,评估发作情况及药物不良反应
-之后每3个月随访1次,复查EEG及血药浓度
-每年进行1次全面评估(神经心理测试、MRI)
“继发性癫痫发作6次”不是疾病的终点,而是干预的关键起点。通过系统评估与个体化干预,约60%-70%的患者可在此阶段实现发作控制,阻止疾病向难治性方向发展。尤其对于药物难治性癫痫候选者,及时的手术或神经调控评估可显著改善预后。医患共同参与的全程管理模式,包括详细的发作记录、规律的随访监测及生活方式调整,是提高治疗效果的重要保障。
继发性癫痫常见问题答疑
继发性癫痫能彻底治愈吗?
继发性癫痫的治愈可能性取决于病因与干预时机。对于病因可去除者(如脑肿瘤切除、脑外伤血肿清除),约40%-60%的患者在规范治疗后可达到临床治愈(连续5年无发作且EEG正常)。但对于病因无法根除的患者(如遗传性神经发育异常),需长期抗癫痫药物控制发作。早期诊断、及时干预及规范治疗是提高治愈率的关键。
发作时如何进行现场急救?
癫痫发作时的正确处理可降低风险:
1.确保安全:移开周围尖锐物品,避免患者受伤
2.保持呼吸道通畅:将患者头偏向一侧,清除口腔分泌物
3.不要强行约束:避免按压肢体,防止骨折
4.记录发作时间:若发作持续>5分钟,或两次发作间隙意识未恢复,立即呼叫急救
5.不要喂药喂水:发作时吞咽反射减弱,避免窒息
抗癫痫药物需要终身服用吗?
是否终身服药取决于病情:
可停药情况:连续2-5年无发作、EEG正常、病因控制良好者,可在医生指导下逐渐减停药物,复发风险约10%-15%
需长期服药情况:药物难治性癫痫、病因无法去除、EEG持续异常者,需长期服药
减药原则:每次仅减一种药物,至少间隔3个月,减药过程持续6-12个月
继发性癫痫患者可以怀孕吗?
怀孕前需做好规划:
1.孕前评估:由神经科与产科医生共同评估发作控制情况、AEDs致畸风险
2.药物调整:优先选择致畸性低的药物(如左乙拉西坦、拉莫三嗪),避免丙戊酸钠
3.叶酸补充:孕前3个月开始每日补充叶酸4-5mg,降低胎儿神经管畸形风险
4.孕期监测:定期产检,孕中期行胎儿超声心动图及神经管畸形筛查
5.分娩准备:告知产科医生病史,发作风险高者可考虑剖宫产
发热时如何预防癫痫发作?
发热期间癫痫发作风险增加,可采取以下措施:
积极退热:体温≥38℃时使用对乙酰氨基酚,避免阿司匹林
增加药物监测:发热期间每周检测AEDs血药浓度,必要时临时增加剂量
预防脱水:多饮水,保持电解质平衡
控制感染:及时治疗发热病因,如细菌感染时尽早使用抗生素
密切观察:记录发热期间的发作情况,出现抖动症状时鉴别寒颤与癫痫发作
继发性癫痫会遗传给下一代吗?
遗传性因素导致的继发性癫痫(如结节性硬化、离子通道病)存在遗传风险,其他病因(如脑外伤、感染)通常不遗传:
遗传方式:多数为常染色体显性遗传,少数为隐性遗传或X连锁遗传
遗传咨询:有家族史者孕前进行基因检测,评估遗传风险
产前诊断:高风险家庭可通过绒毛活检或羊水穿刺进行胎儿基因检测
长期服用抗癫痫药物有哪些副作用?
常见副作用包括:
神经系统:头晕、嗜睡、共济失调(多见于苯妥英钠、卡马西平)
消化系统:恶心、肝功能异常(丙戊酸钠需定期查肝功能)
血液系统:白细胞减少、血小板减少(苯巴比妥罕见)
代谢内分泌:体重增加(丙戊酸钠)、骨质疏松(长期酶诱导剂)
皮肤反应:皮疹(卡马西平、拉莫三嗪),严重者需停药
胎儿致畸:丙戊酸钠风险最高,其他药物风险较低
定期复查(血常规、肝肾功能、血药浓度)可早期发现副作用,及时调整治疗方案。
- 文章标题:继发性癫痫发作怎么办?掌握类型、前兆表现、频率规律(多久一次?)及关键时刻的急救措施
- 更新时间:2025-06-18 16:37:54

 400-029-0925
400-029-0925