胶质瘤英文:Glioma,胶质瘤作为中枢神经系统常见的原发性肿瘤,其复杂性和难治性一直是医学研究的重点。当体检报告或诊断结果中出现“胶质瘤”字样时,多数人会感到困惑——这究竟是一种什么疾病?如何分类分级?治疗手段有哪些进展?《中国中枢神经系统胶质瘤诊疗指南(2024版)》指出,我国胶质瘤年发病率约为5-8/10万,占颅内肿瘤的30-40%,且不同类型和级别的胶质瘤预后差异显著。
胶质瘤是什么病
胶质瘤起源于神经胶质细胞,包括星形胶质细胞、少突胶质细胞等支持神经功能的细胞类型。与神经元不同,胶质细胞不直接参与电信号传导,却承担着营养支持、髓鞘形成等重要功能。当这些细胞因基因突变等原因异常增殖时,就会形成胶质瘤。2023年神经肿瘤学研究显示,约85%的胶质瘤为星形细胞瘤谱系,10-15%为少突胶质细胞瘤或混合性胶质瘤。
这种肿瘤的特殊性在于:
浸润性生长:不像脑膜瘤有明确边界,胶质瘤常沿神经纤维束扩散,手术难以完全切除;
分子异质性:相同病理类型的肿瘤可能具有不同的基因表达,导致治疗反应差异大;
血脑屏障影响:多数化疗药物难以透过屏障,增加了治疗难度。
胶质瘤分类:基于细胞起源的病理分型
一、星形细胞肿瘤
弥漫性星形细胞瘤(WHOⅡ级):
占低级别胶质瘤的60%,生长缓慢,常见于30-50岁人群,2024年病理数据显示,其中IDH突变型占80%,预后相对较好。
间变性星形细胞瘤(WHOⅢ级):
细胞异型性明显,增殖活跃,约50%伴有IDH突变,中位生存期3-5年。
胶质母细胞瘤(WHOⅣ级):
恶性程度最高,占高级别胶质瘤的55%,90%为IDH野生型,5年生存率仅5-10%,是临床治疗的难点。
二、少突胶质细胞肿瘤
少突胶质细胞瘤(WHOⅡ级):
占胶质瘤的10-15%,常见1p/19q共缺失,对化疗敏感,术后联合放疗可延长生存期至10年以上。
间变性少突胶质细胞瘤(WHOⅢ级):
侵袭性较强,但仍保留部分少突胶质细胞特征,治疗策略与Ⅱ级类似但更积极。
三、混合性胶质瘤
少突-星形细胞瘤(WHOⅡ-Ⅲ级):
兼具两种细胞特征,分子病理检测需同时评估IDH突变和1p/19q状态,2025年NCCN指南推荐个体化治疗。

胶质瘤分级
一、WHO分级标准(2021版)
1.Ⅰ级:
良性,如毛细胞型星形细胞瘤,常见于儿童,手术全切后预后良好,5年生存率>90%。
2.Ⅱ级:
低度恶性,细胞轻度异型,无或少量有丝分裂象,术后易复发,需长期随访。
3.Ⅲ级:
间变性,细胞异型性明显,有丝分裂活跃,术后需联合放化疗,中位生存期3-5年。
4.Ⅳ级:
高度恶性,具有坏死或血管内皮增生,如胶质母细胞瘤,进展迅速,需综合治疗改善生存。
二、分级与预后关联
-低级别的Ⅱ级胶质瘤中位生存期5-10年,而Ⅳ级胶质母细胞瘤仅12-15个月(2023年全球肿瘤统计数据)。
-分子标志物如IDH突变、TERT启动子突变等可细化预后评估,例如IDH突变型Ⅱ级胶质瘤10年生存率达60%,而野生型仅30%。
胶质瘤诊疗指南
一、诊断流程
(一)影像学检查
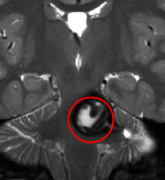
MRI平扫+增强:是首选检查,T2/FLAIR显示肿瘤范围,增强扫描评估血供,2024年指南推荐常规行MRS(磁共振波谱)鉴别肿瘤与炎症。
PET-CT:用于鉴别复发与放射性坏死,18F-FDG摄取增高提示活性肿瘤。
(二)病理活检
立体定向活检:适用于深部或功能区肿瘤,诊断准确率95%,并发症率<3%。
分子检测:必须包括IDH、1p/19q、TERT、ATRX等,指导治疗及预后判断。
二、治疗方法与方案
(一)手术治疗
最大安全切除:是胶质瘤的基础治疗,显微镜下全切可使Ⅱ级胶质瘤无进展生存期延长2倍(2025年手术共识)。
功能区保护:术中神经电生理监测可降低偏瘫、失语风险,尤其适用于左脑半球肿瘤。
(二)放射治疗
常规分割放疗:高级别胶质瘤术后推荐总剂量60Gy/30次,低级别肿瘤可观察或低剂量(50-54Gy)。
立体定向放疗:用于复发肿瘤或残留病灶,单次剂量15-20Gy,精准保护正常组织。
(三)化学治疗
替莫唑胺(TMZ):
高级别胶质瘤同步放化疗(75mg/m²/d)及辅助化疗(150-200mg/m²,5/28方案),可使胶质母细胞瘤中位生存期从12个月延长至14.6个月。
PCV方案:
用于少突胶质细胞瘤(甲基苄肼+环己亚硝脲+长春新碱),联合放疗对1p/19q共缺失者效果显著。
三、治疗现状与进展
电场治疗(TTFields):
2023年NCCN指南推荐用于胶质母细胞瘤术后,通过低频交变电场抑制肿瘤细胞分裂,联合TMZ可使中位生存期达20.9个月。
免疫治疗:
PD-1抑制剂单药效果有限,目前尝试与肿瘤疫苗(如GFAP疫苗)联合,处于Ⅱ期临床试验阶段。
胶质瘤靶向治疗
一、基于分子靶点的治疗策略
(一)IDH突变靶向
IDH1抑制剂(如ivosidenib):
用于复发的IDH1突变型胶质瘤,2024年临床试验显示,客观缓解率达42%,疾病控制率80%。
代谢调控:
IDH突变导致2-HG积聚,抑制组蛋白去甲基化,靶向药物可恢复正常表观遗传调控。
(二)VEGF通路抑制
贝伐珠单抗:
用于复发胶质母细胞瘤,通过抑制血管生成减轻水肿,改善生活质量,但对总生存期影响有限。
(三)PI3K/AKT通路靶向
mTOR抑制剂(如依维莫司):
用于伴有PTEN突变的胶质瘤,临床试验显示可延缓复发,但需注意肺炎等副作用。
二、新兴治疗方向
CAR-T细胞治疗:
靶向IL13Rα2或EGFRvⅢ,Ⅰ期试验显示安全性良好,部分患者出现肿瘤缩小。
溶瘤病毒:
如ONCOS-102,通过选择性感染肿瘤细胞并释放免疫因子,联合放疗可增强效果。
胶质瘤是恶性肿瘤吗?与胶质母细胞瘤的区别
一、良恶性界定
-并非所有胶质瘤都是恶性:
-Ⅰ级胶质瘤(如毛细胞型星形细胞瘤)属于良性,手术全切后可治愈;
-Ⅱ级为低度恶性,Ⅲ-Ⅳ级为高度恶性,其中Ⅳ级胶质母细胞瘤是最恶性的类型。
二、与胶质母细胞瘤的关键差异
| 特征 | 胶质瘤(泛指) | 胶质母细胞瘤(GBM) |
| WHO分级 | Ⅰ-Ⅳ级 | Ⅳ级 |
| IDH突变率 | Ⅱ-Ⅲ级约60-80% | 仅5-10% |
| 中位生存期 | Ⅰ级>10年,Ⅱ级5-10年 | 14-16个月 |
| 治疗重点 | 手术+长期随访 | 综合治疗(手术+放化疗+电场) |
胶质瘤治疗费用
一、诊断阶段
-影像学检查:MRI+增强约3000-5000元,PET-CT约7000-10000元;
-病理活检:穿刺+分子检测约8000-15000元,基因检测(全外显子)约5000-10000元。
二、治疗阶段
(一)手术费用
-开颅手术:5-10万元(医保报销后自付2-4万元),功能区手术(如神经导航)增加2-3万元。
(二)放疗费用
-常规放疗:3-5万元(报销后1-2万元),质子治疗:20-30万元(自费为主)。
(三)药物费用
-替莫唑胺:国产药每周期约5000-8000元,进口药(蒂清)约1.5-2万元,医保报销50-70%;
-靶向药物:IDH抑制剂每月约3-5万元,部分纳入商业保险;
-电场治疗设备:一次性贴片每月约1.5-2万元,可连续使用至疾病进展。
三、长期管理
-复查MRI:每3-6个月1次,每次1000-2000元;
-康复治疗:肢体功能障碍者每月约5000-10000元。
常见问题答疑
胶质瘤能彻底治愈吗?
取决于类型和级别呀。Ⅰ级胶质瘤手术全切后多可治愈,Ⅱ级争取长期无进展生存,Ⅲ-Ⅳ级难以治愈但可通过综合治疗延长生命。
低级别的胶质瘤需要化疗吗?
不一定哦。Ⅱ级胶质瘤若为IDH突变且全切,可观察;若有残留或IDH野生型,需考虑化疗,具体遵医嘱。
靶向治疗比传统化疗效果好吗?
靶向治疗更精准,但目前多数仍处于研究阶段,仅IDH抑制剂等少数药物证实有效,常与传统治疗联合使用。
胶质母细胞瘤还有治疗希望吗?
尽管凶险,规范治疗(手术+放化疗+电场)可显著改善生存,部分患者生存期超过2年,且新疗法(如免疫治疗)在不断进展。
治疗期间饮食需要注意什么?
建议高蛋白、高纤维饮食,补充Omega-3脂肪酸(如深海鱼),避免辛辣刺激。放化疗期间可咨询营养师制定个性化方案。
胶质瘤的诊疗已进入分子精准医学时代,从传统的手术+放化疗模式,发展到结合分子靶点的个体化治疗。对于患者而言,早期明确病理类型和分子特征,选择多学科协作的诊疗中心,是改善预后的关键。随着电场治疗、靶向药物等新手段的普及,以及免疫治疗的突破,未来胶质瘤的治疗前景将不断改善。保持积极心态,配合规范治疗,仍有望在与疾病的抗争中争取更好的生活质量。
- 文章标题:胶质瘤分类分级分型及诊疔指南【收藏】
- 更新时间:2025-06-27 16:32:44

 400-029-0925
400-029-0925