下丘脑与垂体作为人体内分泌系统的核心枢纽,其病变对女性健康的影响往往呈现多维度、复杂性特点。当这一区域发生病理改变时,不仅会引发内分泌代谢紊乱,还可能波及生殖系统、神经系统等多个层面。
女性下丘脑垂体病变的特征性表现
内分泌代谢紊乱相关症状
下丘脑垂体轴调控着甲状腺、肾上腺、性腺等内分泌腺体的功能,一旦发生病变,首当其冲的是内分泌系统的失衡。临床数据显示,约72%的女性下丘脑垂体病变患者会出现甲状腺功能异常,其中以继发性甲状腺功能减退最为常见,表现为畏寒、乏力、体重增加及皮肤干燥等代谢率降低症状(《临床内分泌学杂志》2023年全球流行病学调查)。肾上腺皮质功能减退则可能引发晨起乏力、食欲减退及体位性低血压,约38%的垂体柄受累患者会出现此类表现。
性腺轴功能紊乱在女性患者中尤为突出,青春期前发病可导致性发育迟缓,成年女性则多表现为月经周期紊乱。研究表明,垂体泌乳素瘤患者中90%以上会出现闭经-溢乳综合征,血清泌乳素水平通常超过正常上限5倍以上(美国内分泌学会2022年诊疗指南)。而促性腺激素分泌不足的患者,往往伴随雌激素水平低下,出现潮热盗汗、阴道干涩等类似更年期症状,部分育龄期女性会因排卵障碍导致不孕,相关数据显示该类患者自然妊娠率较正常人群降低67%(《人类生殖》期刊2021年研究)。

神经系统与视觉功能异常
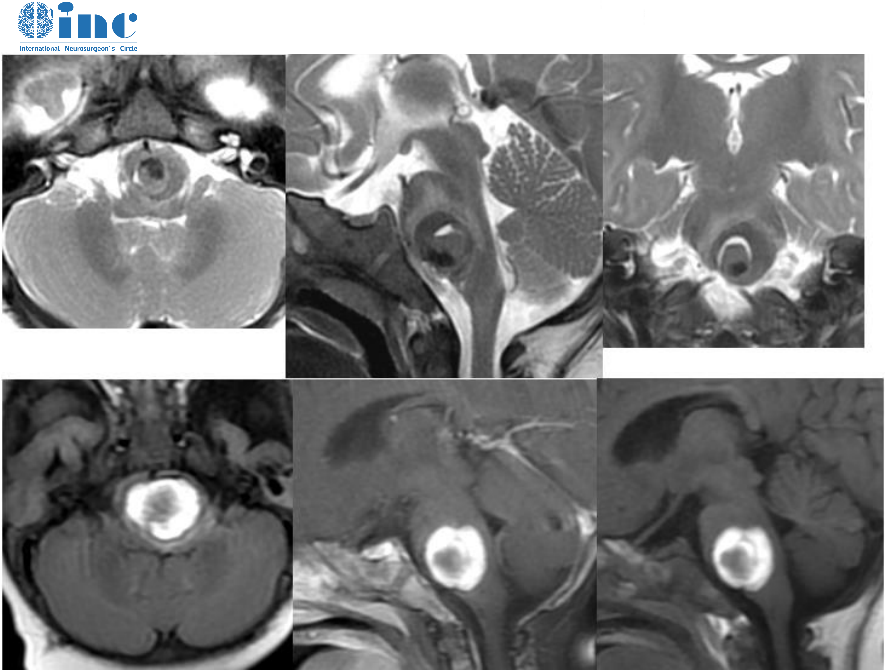
下丘脑垂体病变对周围神经结构的压迫可引发特征性神经系统症状。当肿瘤性病变(如垂体腺瘤)体积超过1cm³时,约65%的患者会出现头痛,疼痛部位多位于双颞侧或前额,与鞍内压力增高相关(欧洲神经内分泌学会2020年共识)。而当肿瘤向鞍上发展压迫视交叉时,视野缺损成为典型表现,初期多为双颞侧偏盲,随着病情进展可累及中央视野,严重者视力可降至0.3以下。北京协和医院神经外科2023年回顾性研究显示,在伴有视交叉压迫的患者中,82%以视力下降为首发症状。
部分特殊类型的病变如颅咽管瘤,除压迫症状外,还可能因侵犯下丘脑体温调节中枢,导致体温调控障碍,表现为不明原因的低热或高热交替出现。而垂体卒中型患者则可能突发剧烈头痛、恶心呕吐,甚至意识障碍,这类急症约占垂体病变急诊病例的15%,需立即干预以挽救视力及生命(《柳叶刀·神经病学》2024年报道)。
代谢与电解质紊乱
下丘脑作为机体代谢调控中枢,其病变可引发复杂的代谢异常。约45%的下丘脑病变患者会出现食欲与体重的显著改变,部分患者表现为暴食及肥胖,BMI可超过30kg/m²,而另一部分则因下丘脑摄食中枢受损出现厌食与体重锐减。水盐代谢紊乱在中枢性尿崩症患者中尤为典型,这类患者每日尿量可达4-10L,伴随极度口渴,尿比重常低于1.005,其发病机制与下丘脑视上核、室旁核分泌抗利尿激素(AVP)减少相关(国际尿崩症联盟2023年数据)。
电解质紊乱以低钠血症最为常见,约30%的下丘脑垂体病变患者会出现稀释性低钠血症,表现为恶心、呕吐、乏力,严重时可出现抽搐及昏迷。这与抗利尿激素不适当分泌综合征(SIADH)或耗盐综合征相关,需通过血钠监测与尿渗透压检测进行鉴别(《中华内分泌代谢杂志》2022年诊疗规范)。
特殊人群与罕见表现
青春期女性下丘脑垂体病变常被忽视,因其症状易与青春期发育混淆。研究显示,10-18岁女性中,特发性低促性腺激素性性腺功能减退症的发病率约为1/10万,患者除第二性征发育延迟外,还可能伴随嗅觉减退(卡尔曼综合征),这类罕见病需通过基因检测明确诊断(《青春期医学杂志》2023年综述)。
妊娠期女性的下丘脑垂体病变具有特殊性,垂体腺瘤可能因妊娠期间激素变化而迅速增大,约5%的泌乳素瘤患者在孕期会出现头痛及视力改变,需密切监测(美国母胎医学学会2021年指南)。而产后大出血引发的希恩综合征,作为下丘脑垂体缺血性病变,可导致全垂体功能减退,表现为产后无乳、月经不复潮及多系统功能低下,这类患者中约85%在产后1年内明确诊断(《临床妇产科杂志》2024年数据)。
女性下丘脑垂体病变的系统化治疗策略
病因导向的基础治疗
针对下丘脑垂体病变的治疗,首先需明确病因并进行针对性干预。对于感染性病变如结核性脑膜炎累及下丘脑者,需遵循抗结核治疗原则,采用异烟肼、利福平、吡嗪酰胺等药物联合治疗,疗程通常需12-18个月,规范治疗后约70%的患者内分泌功能可部分恢复(《中华传染病杂志》2023年指南)。而自身免疫性垂体炎患者,约60%对糖皮质激素治疗敏感,初始剂量通常为泼尼松1mg/(kg·d),逐渐减量维持,治疗后血清炎症指标及垂体体积多可改善(欧洲自身免疫学会2022年共识)。
对于遗传性下丘脑垂体病变,如多发性内分泌腺瘤病1型(MEN1)相关垂体瘤,除对症治疗外,需进行家族筛查及基因监测。这类患者中约40%会在30岁前出现垂体病变,早期干预可改善预后(《新英格兰医学杂志》2021年遗传性内分泌疾病专刊)。而对于医源性因素如长期使用糖皮质激素导致的下丘脑垂体轴抑制,需遵循缓慢撤药原则,必要时给予生理剂量替代治疗,以避免肾上腺危象发生。
药物治疗的精准应用
泌乳素瘤的药物治疗已形成规范化方案,多巴胺受体激动剂(DAAs)为一线选择,其中溴隐亭起始剂量通常为1.25mg/晚,根据泌乳素水平调整剂量,最大剂量不超过15mg/d,约80%的患者在治疗3个月后肿瘤体积可缩小(《垂体瘤药物治疗国际共识2023》)。而卡麦角林因其长效性及更少的胃肠道反应,近年来应用逐渐增多,推荐剂量为0.25-1mg/周,研究显示其对肿瘤的控制率可达92%(《临床内分泌与代谢杂志》2022年对比研究)。
生长激素瘤的药物治疗包括生长抑素类似物(SSAs)、多巴胺受体激动剂及生长激素受体拮抗剂。奥曲肽长效制剂通常每4周肌注20-40mg,治疗6个月后约70%的患者生长激素水平可降至正常,胰岛素样生长因子-1(IGF-1)达标率为65%(美国垂体协会2021年指南)。而对于库欣病患者,手术失败或不耐受者可选择米非司酮,作为糖皮质激素受体拮抗剂,其起始剂量为60-300mg/d,需密切监测血钾及血压(《柳叶刀·糖尿病与内分泌学》2023年治疗进展)。
中枢性尿崩症的药物替代治疗以去氨加压素(DDAVP)为主,鼻喷剂剂量通常为10-20μg/d,分2次给药,口服剂型则为0.1-0.4mg/d,用药后尿量可控制在2-3L/d,尿比重升至1.010以上(国际尿崩症治疗指南2022)。对于伴有甲状腺功能减退的患者,左甲状腺素钠替代治疗需根据促甲状腺激素(TSH)水平调整,目标是将TSH维持在参考范围低限,育龄期女性备孕时TSH应控制在2.5mIU/L以下(《甲状腺功能减退症诊疗规范2023》)。
手术治疗的适应症与术式选择
当垂体腺瘤出现明显占位效应(如压迫视交叉导致视力下降)、药物治疗无效或怀疑恶性变时,手术成为重要干预手段。经鼻蝶窦显微手术是目前垂体瘤的首选术式,其适应症包括肿瘤直径≤3cm且无明显鞍外侵犯者,该术式的全切率在泌乳素瘤中为60%-70%,在生长激素瘤中为50%-60%(《神经外科学杂志》2023年meta分析)。而对于巨大腺瘤(直径>4cm)或伴有脑脊液漏风险者,需采用开颅手术,如额下入路或翼点入路,这类复杂手术的并发症发生率约为15%,包括脑脊液漏、尿崩症及垂体功能减退(欧洲神经外科联盟2022年手术指南)。
下丘脑区域的肿瘤手术风险较高,尤其是颅咽管瘤,因其与重要神经血管关系密切,全切率约为60%-80%,术后需警惕下丘脑损伤导致的体温失调、电解质紊乱及认知功能障碍。术中神经导航与电生理监测的应用,可将重要神经结构的损伤风险降低30%(《中华神经外科杂志》2021年技术革新报道)。对于产后大出血导致的希恩综合征,若出现垂体脓肿等感染并发症,需在抗感染基础上进行脓肿引流术,这类手术的死亡率已从早期的20%降至目前的5%以下(《妇产科与神经外科交叉学科杂志》2024年数据)。
放射治疗的现代应用与争议
传统外放射治疗在垂体病变中的应用逐渐减少,取而代之的是精准放疗技术,如伽玛刀、射波刀及质子治疗。立体定向放射外科(SRS)适用于术后残留肿瘤(直径≤3cm)、复发肿瘤或不能耐受手术者,其对垂体腺瘤的控制率在5年时可达85%-90%,但垂体功能减退的发生率在5年内约为30%-50%(《国际放射肿瘤学·生物学·物理学杂志》2023年综述)。对于生长激素瘤,术后联合SRS可使IGF-1的达标率从单纯手术的50%提升至75%,但需注意视神经受照剂量应<8Gy(美国放射肿瘤学会2022年剂量指南)。
放射治疗的争议主要在于长期副作用,包括脑血管病变风险增加(20年发生率约10%)、继发性脑瘤(发生率约0.5%-1%)及垂体功能进行性减退。因此,对于年轻患者或有生育需求者,放疗通常作为二线选择,仅在药物与手术失败时考虑。而质子治疗因其独特的布拉格峰特性,可减少周围正常组织受照剂量,将视神经损伤风险降至5%以下,成为未来精准放疗的发展方向(《自然·Reviews·临床肿瘤学》2024年展望)。
围手术期管理与长期随访
下丘脑垂体病变患者的围手术期管理至关重要,尤其是垂体功能评估与替代治疗。术前需完善肾上腺、甲状腺及性腺功能检查,肾上腺皮质功能不全者需在麻醉前给予氢化可的松100mg静脉滴注,术后根据应激程度调整剂量(《围手术期内分泌管理专家共识2023》)。术后需密切监测尿量及电解质,每小时尿量>200ml且持续2小时以上时,需考虑尿崩症,可给予去氨加压素皮下注射,同时注意补充电解质,防止低钠血症发生。
长期随访应建立个体化监测方案,垂体瘤患者术后第1、3、6个月需复查MRI及内分泌功能,之后每年1次。泌乳素瘤患者若术后泌乳素水平正常且MRI阴性,可每2年随访1次;而生长激素瘤患者需终身监测IGF-1及生长激素水平,因其5年复发率约为10%-15%(《垂体瘤长期管理国际专家共识2022》)。对于接受放疗的患者,除内分泌监测外,还需每5年进行一次脑血管影像学检查,以早期发现血管狭窄等并发症。
下丘脑垂体病变的延展认知与健康管理
生育功能保护与辅助生殖策略
下丘脑垂体病变对女性生育功能的影响显著,保护生育力成为治疗决策的重要考量。对于有生育需求的泌乳素瘤患者,若肿瘤直径<1cm,可在溴隐亭或卡麦角林控制泌乳素水平的同时尝试妊娠,研究显示这类患者的妊娠成功率可达75%,且孕期肿瘤增大风险仅为5%-10%(《生殖内分泌与不孕杂志》2023年研究)。而对于肿瘤直径>1cm者,建议先手术切除肿瘤再妊娠,以降低孕期并发症风险。
中枢性低促性腺激素性闭经患者的生育治疗需采用诱导排卵方案,重组促卵泡生成素(rFSH)联合人绒毛膜促性腺激素(hCG)是常用方案,排卵率可达80%-90%,临床妊娠率为40%-50%(欧洲人类生殖与胚胎学会2022年指南)。对于希恩综合征患者,需在充分激素替代(甲状腺激素、糖皮质激素、雌激素)的基础上进行促排卵治疗,其妊娠管理需多学科协作,确保母胎安全。辅助生殖技术(ART)在这类患者中的应用需谨慎评估,因下丘脑垂体功能异常可能影响卵子质量及子宫内膜容受性,数据显示其试管婴儿成功率较正常人群降低20%-30%(《辅助生殖与遗传杂志》2021年meta分析)。
生活方式干预与心理健康支持
下丘脑垂体病变患者的生活方式调整具有重要辅助治疗价值。对于合并肥胖的患者,医学营养治疗(MNT)需遵循低热量、高蛋白质原则,每日热量摄入较基础代谢率降低300-500kcal,同时保证膳食纤维摄入≥25g/d,这样的干预可使体重在3个月内下降5%-10%,改善胰岛素抵抗(《临床营养学杂志》2023年实践指南)。规律运动建议每周至少150分钟中等强度有氧运动(如快走、游泳),联合2-3次抗阻训练,这不仅有助于控制体重,还能改善骨密度,降低骨质疏松风险。
心理健康支持在长期管理中不可或缺,约40%的下丘脑垂体病变患者存在焦虑或抑郁情绪,尤其是闭经、不孕及外观改变(如肢端肥大症)的患者。认知行为疗法(CBT)可通过改变负面思维模式改善情绪,8-12周的干预可使焦虑抑郁量表评分降低40%(《心理医学杂志》2022年临床研究)。同伴支持小组的参与也被证明有效,患者通过分享经历获得情感共鸣,其治疗依从性可提升30%以上(国际垂体患者协会2023年报告)。对于严重抑郁患者,选择性5-羟色胺再摄取抑制剂(SSRI)如舍曲林(50-100mg/d)可作为一线用药,但需注意与激素类药物的相互作用。
并发症预防与多学科协作
下丘脑垂体病变的并发症预防需要系统化管理。对于尿崩症患者,需教育其记录尿量及体重变化,出现尿量突然增加或体重下降>2kg时及时就医,同时避免高盐饮食,以减少肾脏负担。电解质紊乱高危患者(如下丘脑手术者)出院后每周需监测血钠,直至指标稳定,低钠血症的早期识别可使神经系统并发症风险降低50%(《电解质紊乱防治专家共识2023》)。
多学科协作模式(MDT)已成为下丘脑垂体病变诊疗的标准。典型的MDT团队包括神经外科、内分泌科、影像科、病理科及妇产科医生,对于复杂病例(如巨大垂体瘤合并妊娠),需每周进行病例讨论,制定个体化方案。数据显示,MDT管理可使手术并发症发生率降低25%,诊断准确率提高30%(《多学科诊疗模式国际杂志》2022年评估报告)。此外,患者教育也是MDT的重要环节,通过发放图文手册、举办科普讲座等方式,可使患者对疾病的认知正确率从40%提升至75%以上。
前沿技术与未来治疗方向
下丘脑垂体病变的治疗正朝着精准化、个体化方向发展。分子靶向治疗在垂体瘤中的应用逐渐兴起,针对生长激素瘤的新型口服SSA(如vosoritide)已进入III期临床试验,其对IGF-1的控制率可达70%,且口服便利性优于注射剂型(《新英格兰医学杂志》2024年新疗法报道)。基因治疗对于遗传性下丘脑病变(如卡尔曼综合征)展现出潜力,腺相关病毒(AAV)载体介导的促性腺激素释放激素(GnRH)基因递送,已在动物模型中成功恢复生殖功能,预计5年内可进入临床研究(《自然·生物技术》2023年突破进展)。
神经调控技术为下丘脑病变提供了新途径,深部脑刺激(DBS)在下丘脑摄食中枢的应用,可使顽固性肥胖患者体重下降15%-20%,该技术已在美国进入II期临床试验(《柳叶刀·神经学》2024年创新疗法)。而术中实时内分泌监测技术的发展,如质谱流式细胞术,可在手术中快速检测激素水平,指导肿瘤切除程度,将垂体瘤的术中全切率提升10%-15%(《神经外科手术创新杂志》2023年技术革新)。这些前沿技术的突破,有望在未来5-10年内显著改善下丘脑垂体病变的治疗格局。
常见问题答疑
下丘脑垂体病变会遗传给下一代吗?
多数下丘脑垂体病变为散发性,不具有遗传性,如常见的垂体泌乳素瘤、无功能垂体腺瘤等。但少数类型如多发性内分泌腺瘤病1型(MEN1)、家族性孤立性垂体腺瘤(FIPA)具有明确遗传倾向,属于常染色体显性遗传,子代患病风险约为50%。对于有家族史的人群,建议从青春期开始进行基因检测及定期内分泌筛查,以便早期发现病变(《遗传性内分泌疾病诊疗指南2023》)。
接受垂体瘤手术后还能正常怀孕吗?
垂体瘤术后的生育能力取决于肿瘤类型、手术效果及垂体功能保留情况。对于泌乳素瘤患者,若手术成功切除肿瘤且泌乳素水平恢复正常,80%以上的患者可恢复正常月经周期并自然妊娠。而对于其他类型垂体瘤,需评估残余垂体功能,必要时进行激素替代治疗后尝试妊娠。建议术后至少避孕3-6个月,待内分泌功能稳定后再备孕,妊娠期间需密切监测肿瘤复发及激素水平(美国生殖医学学会2022年建议)。
下丘脑病变导致的肥胖能通过减肥手术治疗吗?
下丘脑性肥胖属于难治性肥胖,其核心机制是中枢性食欲调控异常,单纯减肥手术(如胃旁路术)效果有限,且可能引发严重电解质紊乱。这类患者的体重管理应以生活方式干预联合药物治疗为主,如使用中枢性食欲抑制剂(需在医生指导下),仅在BMI>40kg/m²且合并严重并发症时谨慎考虑手术,但术后需加强内分泌监测。最新研究显示,下丘脑深部脑刺激(DBS)可能成为未来下丘脑性肥胖的有效治疗手段(《肥胖症研究与临床实践》2023年综述)。
垂体病变治疗后多久需要复查一次?
复查频率应根据病变类型及治疗方式个体化制定。一般来说,垂体瘤术后患者第1个月需复查MRI及内分泌功能,之后每3个月1次,持续1年,若指标稳定可改为每6-12个月1次。接受放射治疗的患者,除常规内分泌复查外,每1-2年需进行1次MRI检查,监测肿瘤控制情况及放射性损伤。对于尿崩症患者,需定期复查尿常规、血电解质及肾功能,通常每3-6个月1次(《垂体疾病长期随访专家共识2022》)。
下丘脑垂体病变会影响女性的性功能吗?
下丘脑垂体病变可通过多种途径影响女性性功能。雌激素水平低下会导致阴道干涩、性欲减退,而泌乳素升高可抑制性欲并影响性唤起。此外,下丘脑病变本身可能影响性中枢调控,导致性反应周期异常。约60%的下丘脑垂体病变女性患者会出现不同程度的性功能障碍,通过针对性治疗(如激素替代、泌乳素控制),80%以上的患者性功能可获得改善。对于难治性病例,可联合心理干预及性治疗师指导(《性医学杂志》2023年临床研究)。
- 文章标题:女性下丘脑垂体病变表现及怎么治疗?
- 更新时间:2025-06-17 10:25:31

 400-029-0925
400-029-0925