半个多世纪以来,立体定向放射外科(SRS)已被用于治疗颅内疾病,包括从功能性适应证到血管病变,以及良性和恶性脑肿瘤。立体定向放射外科(SRS)通常是一个耐受性良好的单日的门诊放射治疗,是与手术相比,有很少的主要风险,并已被证明是一个合适的和起作用的单发及多发病变得治疗。然而,较近癌症患者的生存好转和转移瘤影像学监测的增加,已经造成确定的脑转移瘤的发病率不断上升。这导致使用SRS治疗这些病变呈指数级增长。此外,技术能力的进步都是在过去的十年里大家所目睹的,对医生来说,使用SRS治疗多发性脑转移瘤变得容易得多。
随着SRS治疗的使用增加,不可避免地也会增加放射副反应(ARE)的发生率。放射副反应(ARE)是放射学术语定义为不量的放射治疗后的影像改变,其中一部分可以出现症状。放射副反应(ARE)是按时限阶段(timerelated phase)划分的,基于病理生理学上的损害。早期或急性放射性损伤是发生在治疗期间,或者在暴露于辐射后的几天内,以及SRS治疗后的12周内发生的早期迟发性损伤或假性进展。晚期放射副反应(ARE)在放射治疗后的数月到数年起病的多变,包括白质脑病和放射性坏死(RN)。不像急性和亚急性的放射副反应(ARE),晚期损伤往往是渐进的和不可逆转的。
放射性坏死的流行病学
放射性坏死(RN)是SRS治疗后较常见的副作用之一。它的重要性不仅在于放射性坏死本身会出现症状,因为它(虽然是非肿瘤性的)却是生长性的病变,也当在放射影像学上确定时,很难与肿瘤的再生长相鉴别(图1)。

图1。在MRI上放射性坏死的表现与肿瘤复发难以区分。一例非小细胞肺癌患者出现语言困难和偏瘫。a.SRS时的钆剂后和FLAIR的MRI成像。b. SRS治疗后6个月,治疗效果良好。c. SRS治疗后15个月,阅片认为是肿瘤复发,活检病理与放射性坏死相符。
在Patel等的一项研究中,其中500例转移瘤的体积在SRS治疗后的一段时间内被检测,可以看到,在9到18个月之间,大量的病变在较初有良好的反应后,放射影像学上有重新生长。36例连续病例的再生长的病变手术切除后显示,31%的患者病理符合肿瘤再生长,33%的患者肿瘤样本中肿瘤占比小于2%,36%只含有放射性坏死(RN)的证据。Sneed等,较近报道较大的脑转移瘤的放射性坏死的研究系列。2200例病变治疗后,9.2%的再生长病变是由肿瘤复发(TR)引起的, 5.4%仅因放射性坏死,而1.4%是由于复发和放射性坏死合并存在。
考虑到对这种情况的诊断有持续的挑战性,因此放射性坏死(RN)的真实发病率难以确定。在文献中,SRS治疗后放射影像学报告的放射副反应(ARE)的发病率为范围为5%到68%,神经症状的发生率也在2到14%不等。放射性坏死的放射影像学改变的起病常发生在放射外科治疗后的2个月到10年,85%的病例发生在SRS治疗后3 - 18个月。放射性坏死没有治疗病理特异性,也在SRS治疗脑膜瘤和动静脉畸形后有报道,尽管许多较近的研究多是关于转移瘤的文献。
放射性坏死(RN)的演变过程也是多变的。Patel等显示,放射性坏死病变在病变自行消退前,可以生长到比原来SRS所治疗的病变更大的尺寸。虽然没有已被报道的临床或影像学因素能可靠地评估哪些病变会自行消退,哪些会进展并成为症状性的,Sneed等报告在影像上所观察到的自发好转的概率,在放射性坏死起病后的6,12,和18个月,分别是40,57和76%。这表明即使在再生长开始后的18个月,约25%的病灶无法单用药物治疗解决,可能需要手术干预。
放射性坏死的病理生理学
顾名思义,以前用SRS治疗过的组织的较初的组织学检查显示周围大面积凝固性坏死,通过预期的辐射后改变包括血管玻璃样变和血栓形成,反应性星形细胞增生、脱髓鞘和广泛的巨噬细胞浸润(图2)。然而,所发现的放射性坏死中独特的,是迟发性放射性脑白质病(DRIVL),据Rauch等2012年的报道,迟发性放射性脑白质病(DRIVL)描述跨壁的(transmural)和实质内的血管炎性浸润直接包围坏死区域的组织,提示放射性坏死(RN)是一种免疫介导的现象。而放射性坏死(RN)的病理生理学尚不清楚,对大鼠和人类神经组织的多项研究提供了一些见解。有人提出两个模型来解释放射性坏死的病理生理学 -血管损伤模型和神经胶质损伤模型。两者都不能解释全部的在放射性坏死中可以看到的变化,因此很可能血管损伤和神经胶质损伤两者均可累及。支持血管损伤理论的认为,已知对肿瘤周围正常脑组织的辐射可引起血管内皮损伤和血管闭塞。脑组织内的乏氧可能会导致小胶质细胞因子的释放,包括缺氧诱导因子-1α (HIF-1α)和后续的血管内皮生长因子(VEGF)和CXCL12的表达增加,放射性坏死中两者均显示升高。已知VEGF的超表达会促进脆弱的血管生成和组织水肿-这解释了放射性坏死中的放射影像学变化。神经胶质损伤模型尚不够完善,但似乎从放射性坏死病变中可见广泛的脱髓鞘中得到很好的支持。
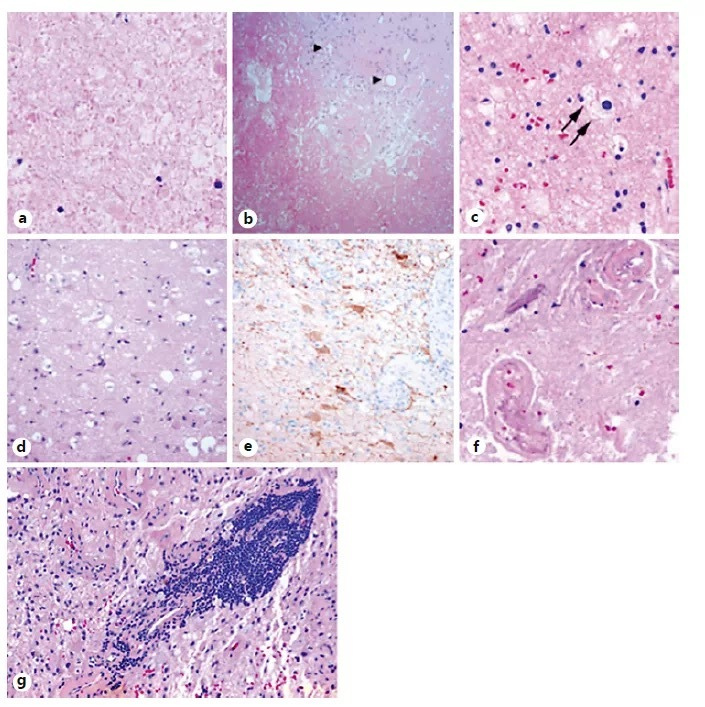
图2。放射性坏死的组织病理学。A.凝固性坏死。b坏死和脱髓鞘之间的明显边界。c巨噬细胞吞噬脱髓鞘产物。d, e 胶质增生。f血管玻璃样变。g跨壁血管炎性,T细胞浸润,脑实质内T细胞和巨噬细胞浸润。
较后,在放射性坏死中,血管周围的T细胞浸润伴细胞因子TNF-α(肿瘤坏死因子-α)和Il - 6(白细胞介素-6)的水平升高,以及巨噬细胞浸润组织,表明在放射性坏死中存在免疫成分。少见的放射性坏死的病例中已报道距离SRS治疗的肿瘤位置较远处的胼胝体和室管膜下区域受累,进一步支持受照辐射后少突细胞损伤造成继发性自身免疫样反应。此外,在较近的一份报道中,Cao等对描述一例76岁患黑色素瘤的女性使用免疫治疗和SRS治疗,患者的MRI上发生多个白质区域的改变。从有白质改变区域的活检中取得的T细胞与健康的和多发性硬化的患者中取得的T细胞作比较,显示从病人身上得到的T细胞增殖率和促炎细胞因子产生的骨髓反应CD4+ (白细胞分化抗原4)高于正常受试者且与多发性硬化症患者相似。需要进一步研究以更好地了解免疫系统参与放射性坏死的产生,特别是随着免疫检查点控制剂越来越普遍用于多种不同类型癌症的治疗的情况下。
发生放射性坏死的危险因素
多项研究显示,,不管具体的治疗平台(LINAC或伽玛刀)或诊断,发生放射性坏死的较重要的独自的危险因素为,放射剂量,治疗体积,和对癌症患者的化疗给药。而动静脉畸形文献中提到> 3cm的病灶放射性坏死的风险增加,Minniti等在转移瘤的文献中使用10-Gy和12 Gy的受照体积(V10和V12)的作为测量的治疗体积,显示V10和V12两者的增加与放射性坏死的发生率增加有关。Chin等随访243例接受SRS治疗的患者,其中17例发生放射性坏死。而他们的分析也确定较重要的因素是放射剂量和治疗体积,17例放射性坏死的患者中有4例曾多次对同一病灶进行放射治疗。Sneed等强烈支持这一发现,他们报道使用立体定性放射外科反复治疗的病变1年的放射性坏死的危险率为20%,而既往未接受过治疗的、既往接受过全脑放疗(WBRT)、和接受过同步全脑放疗(WBRT)的1年的 放射性坏死的危险率分别为3%、4%和8%。此外,与直径在0.3-0.6cm的放射性坏死的1年放射性坏死危险率<1%相比,直径> 2.1 cm、靶区体积> 1.2cm3 、治疗体积> 1.8cm3、V12体积>3.3cm3、和V10体积>4.3cm3的病变的放射性坏死的危险率为13-14%。
同步化疗,如据报道在高剂量放射治疗胶质瘤的过程中使用替莫唑胺治疗会增加放射副反应(ARE)的风险。在转移瘤的文献中,Colaco等回顾总结他们行SRS治疗的经验,并发现37.5%正在接受全身性免疫治疗的患者会发生放射性坏死,相比之下,接受靶向治疗的患者中的25%,接受化疗的患者中只有16.9%会发生放射性坏死。随着开始使用这些新的药物的病人数量的快速增长,重要的是要认识到放射性坏死的发生率今天也在潜在升高。
放射性坏死的诊断
识别放射性坏死,特别是区分放射性坏死与肿瘤复发(TR),是指导治疗范例中至关重要的。较重要的困境在于事实上肿瘤复发(TR)和放射性坏死(RN)的临床表现和影像学表现是无法区分的。通过肿瘤复发(TR)和放射性坏死(RN)的常规的成像技术,对比增强计算机断层摄影,以及磁共振成像(MRI)的图像均可以呈现生长的、不规则的、边缘强化的病灶伴周围水肿和肿块占位效应。临床表现是取决于病变的大小、位置和水肿程度,与病因无关。Narloch等报道从SRS治疗到影像学改变起病的时间有助于评估诊断(52.5%的肿瘤复发患者小于9个月,而相对的是,65.7%的放射性坏死患者>9个月, p = 0.004),但65.7%的患者需要行活检以决定如何处理。诊断的黄金标准因此仍需获得组织的组织学分析,特别是活检的诊断准确性显示为> 大概率,而有< 1%的长期性并发症风险。然而,支持侵袭性较低的检查手段,是对有脑转移瘤的4期癌症患者,临床医生和研究人员侧重于使用不同的成像方式来帮助诊断。
磁共振成像
病变形态
MRI是今天大多数颅内成像的主要手段。较初的鉴别肿瘤复发与放射性坏死的报道讨论钆剂增强T1加权磁共振成像上的病变形态。与复发肿瘤中有更多的结节样改变相比,放射性坏死的病变被描述为“肥皂泡(soap bubble)样”,“瑞士奶酪(swiss cheese)样”和“切开的灯笼椒(cut bell pepper)样”的表现。有些病变是可以从形态学上辨别的,也同样有很好的报道,放射性坏死(RN)和肿瘤复发(TR)病变有时在结构的MRI上难以区分。
表观扩散系数(ADC)被应用于识别放射性坏死有互相冲突的结果。一些研究表明,应在肿瘤复发(TR)中看到低ADC,继发于肿瘤细胞的富细胞性,限制细胞外的水弥散,而放射性坏死中ADC值较高,因为坏死区域缺乏细胞结构。然而,肿瘤也被证明有坏死中心和多变的细胞,因此很难确定ADC截值,从而能以这种方式进行简单的鉴别。在Detsky等较近的一项研究中,研究10个病变,获取的组织学检查显示ADC无法鉴别两种诊断(肿瘤复发的ADC值平均为1.1±0.2,相比放射性坏死的ADC值为1.2±0.4,p = 0.6)。
T1 / T2不匹配
建议的另一种鉴别方法是由Dequesada等对619例患者开发的用病变体积与水肿体积相比计算出商。这个值定义为在T2加权成像上的结节区域除以T1对比增强区域的比值。肿瘤复发时的该比值大于0.6,放射性坏死的该比值小于0.3。不幸的是,Stockham等的一项研究显示,将其应用于57处已知组织学诊断的病灶,评估放射性坏死的病变商的阳性评估值仅为25%, 评估肿瘤的病变商的阳性评估值为62%。
磁共振波谱和磁共振灌注
磁共振波谱(MRS)和磁共振灌注(MRP)成像测量新陈代谢和生理,在理论上可以鉴别肿瘤复发和放射性坏死。使用MRS检测标准的代谢物信号,包括N-乙酰天冬氨酸(NAA)、胆碱(Cho)、肌酐(Cr)、乳酸和脂质。N-乙酰天冬氨酸(NAA)是神经元活力的标志,胆碱(Cho)、肌酐(Cr)是细胞膜周转(turnover)的标志,而肌酐(Cr)反映正常细胞的代谢。在正常组织中看不到脂质和乳酸峰,但可以考虑为坏死和缺氧的标志。预期的肿瘤的MRS谱,应该是Cho升高和NAA降低,而放射性坏死(RN)应该降低N-乙酰天冬氨酸(NAA)和胆碱(Cho)伴随乳酸和脂质峰值升高。然而,回顾文献表明在鉴别肿瘤复发(TR)和放射性坏死(RN)中MRS的成功存在的变异性。在van Dijken等的荟萃分析中,9项研究中的203例患者的MRS的敏感性和特异性分别为91%和95%。然而,仔细看审视在每项研究中实际测量,显示被测量的比率有差异,包括Cho/Cr、Cho/NAA、Lac/Cho、Lac/NAA,以及每一个的单独测量的峰值。此外,鉴别肿瘤复发(TR)和放射性坏死(RN)的很多数据是基于神经胶质瘤的成像。Chuang等关于磁共振灌注(MRP)的荟萃分析中,使用该技术的13项研究显示相对脑血容量(rCBV)在肿瘤复发(TR)中作为血管新生的标志较高,而在放射性坏死中,作为非肿瘤性病变较低。报道中,使用这种成像方式,敏感性和特异性的范围> 90%,目前有持续的兴趣用于更好地鉴别肿瘤复发(TR)和放射性坏死(RN)。然而,这些数据中较大的局限性在于许多研究没有组织学证实的诊断。在我们医院,回顾这些影像模式的准确性以评估病理,经活检证实,显示ADC(表观弥散系数的)准确率为49%,使用Cho/NAA比值截断值取2.0的MRS的准确率为 62%,使用相对血容量(rCBV)截断值>2.0时,磁共振灌注(MRP)的准确率为65%。
核医学成像
FDG-PET
PET使用2-脱氧-[18F]氟-D -葡聚糖(FDG)测量组织内细胞对葡萄糖的吸收。 理想情况下,高级别肿瘤应该显示细胞代谢增加,可见肿瘤区域内FDG摄取增加。然而,FDG-PET的敏感性受限于脑内高的生理性葡萄糖消耗,肿瘤摄取多变,且检测小肿瘤的能力有限。
氨基酸PET
在神经胶质瘤和转移瘤中的氨基酸摄取均高,而正常大脑的氨基酸摄取低,产生的对比,因此增加了检测能力。11C-蛋氨酸(methionine)-PET在几个中心显示在肿瘤与放射性坏死的鉴别诊断中有很高的诊断准确性水平,但是它的使用受到了11C同位素短半衰期的限制,使得有必要有一个现场回旋加速器使这个选项可用。在较近的Tomura等的研究中,比较FDG-PET、 MRP、和ADC,以及曲线下面的区域,较适合用11 C-蛋氨酸鉴别肿瘤复发(TR)与放射性坏死RN。然而,制作这些PET化合物的成本,限制了其在标准临床实践中的使用。
铊- 201 SPECT
201TI(铊)SPECT在过去已经被研究过,但SPECT的空间分辨率被认为比PET的低,从而限制了其在标准临床实践中的应用。
放射性坏死的处理
放射性坏死(RN)的治疗在个体之间存在差异取决于临床情况。对于大多数接受过SRS治疗的转移瘤患者,定期磁共振监测通常是针对检测新的转移瘤,因此检测病变的再生长可以发生在出现症状以前。根据病变的大小和位置,在放射性坏死的整个过程中,可能患者可以保持无症状。在Sneed等的研究中,118例放射性坏死中,只有60%是有症状的。因此如果病变小且无症状,放射性坏死可以被保守治疗,因为这种疾病并不总是进展性的。对于有症状的病变,治疗可分为药物和外科干预。
因此,放射性坏死处理的一步,是在鉴别诊断SRS治疗后任何再生长的病变时,识别有可能是放射性坏死。病人接受同时进行靶向治疗或免疫治疗时如此。此外,在用较佳剂量照射> 9个月后,全身疾病得到很好的控制,或者没有证据表明存在残留的全身性疾病,而SRS治疗的病灶有再生长的患者,需要仔细考虑放射性坏死。较后,放射性坏死(RN)需要考虑在同一个大脑区域是否发生过任何类型的再照射。如果对诊断有疑问,且病人是无症状的,无论是观察还是活检,即便有错也比主观性的再照射更顺利。图3强调了这一点。

图3。未识别的放射性坏死(RN)的演变。一例乳腺癌患者伴有6处颅内转移瘤,较初接受全脑放疗35Gy,使用SRS推量14Gy治疗6处病变。SRS治疗后10个月的影像学报告为复发性转移瘤或新发病变。c.SRS治疗后12个月,病灶继续生长。诊断推测是肿瘤及再次SRS 治疗(7 Gy×2)。d.二次SRS治疗后三个月,检查到病灶进一步生长。FDG-PET呈阳性边缘(e), MRS呈Cho/NAA 升高(f)。再次诊断为肿瘤复发,咨询手术切除,病变病理显示未发现肿瘤。
药物治疗
皮质激素长期以来一直是放射性坏死治疗的主要药物。它的作用机制是假定既能抗炎又能有使血脑屏障稳定的特性,减少水肿。目前还不清楚是否类固醇本身会影响放射性坏死的过程,尽管有可能假定类固醇具有免疫控制作用,而且对一些病人来说,这可能足以改变放射性坏死的过程。在Sneed等的研究中,76%使用类固醇是可控的,只有连续成像。在其余的患者中,有些会发生症状进展,尽管使用了类固醇,而其他患者可能不能耐受这种药物,由于药物有大量的副作用。
在一项随机性研究中,其他显示合适的药物是贝伐单抗。贝伐单抗是是人源化单克隆抗体,针对血管内皮生长因子(VEGF),并阻止它损害血脑屏障内皮。这导致在MRI上对比增强后和FLAIR容积有放射影像学上的的缩小,以及临床的神经功能好转能减少或停止类固醇的使用。然而,值得注意的是,贝伐单抗也有明显的副作用,包括发生肺栓塞、深静脉血栓形成和静脉窦血栓形成。
高压氧也被用于处理放射性坏死,且在理论上促进血管新生,恢复缺氧组织的循环。数据显示,由于高压氧实施起来麻烦,这种治疗只在有限的中心提供,因此没有关于其疗效的任何大规模的随机研究。
据报道,血液稀释剂有治疗放射性坏死的疗效,其中包括阿司匹林、肝素、华法林和己酮可可碱同时使用维生素E。使用这些药物的益处的循证证据仍然属于传闻(anecdotal)。
手术干预
和脑部其他生长的病变类似,手术切除可立即缓解肿块占位效应,作出组织诊断,而且,神经系统症状快速恢复。因此,,对病变接近或就在脑表面很容易到达,以及患者有良好的术前健康状况,开颅手术仍然是一个合适和合适的选择。几份报告显示放射性坏死(RN)患者有良好的预期中位生存,术后31 -47个月。此外,放射性坏死的手术切除往往导致完全的局部控制。
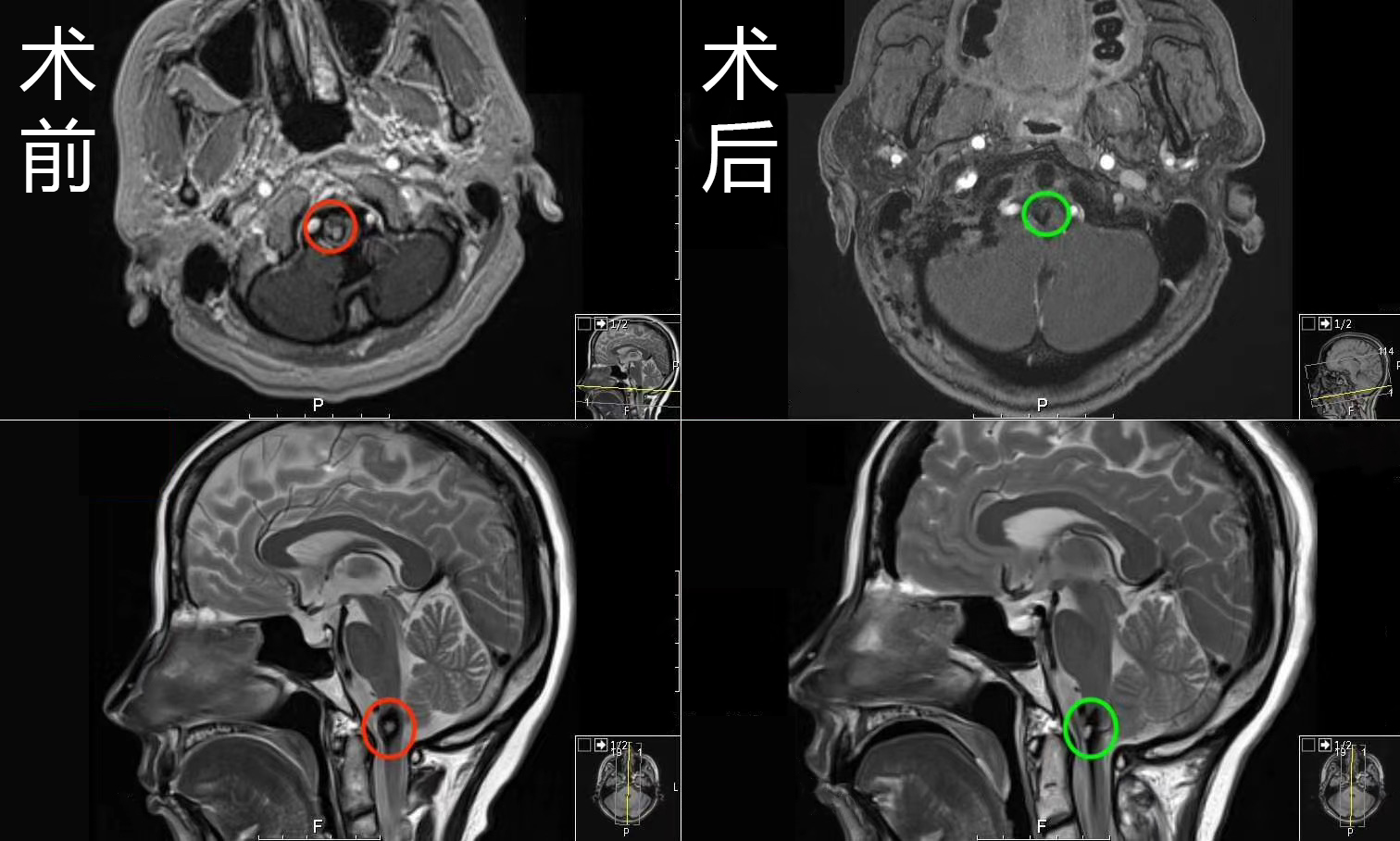
对于深部病变或术前状态不良的患者,激光间质热疗(LITT)是一种微创替代手术的技术。通过头皮上的小切口并钻孔,可获得活检进行诊断。使用同样的轨迹,然后将一个二较管激光光纤插入到病变中心。放置后通过成像确认,热量被传递到组织,病变温度是实时测量,使用磁共振梯度回波成像转换成治疗映射图。现在多个回顾性研究已经证明激光间质热疗(LITT)在治疗放射性坏死(RN)和转移性肿瘤两方面均为合适(图4)。这个方法的优势之一是,在活检时,不管诊断结果如何,可以实施治疗。鉴于LITT成功治疗放射性坏死和转移性肿瘤,几个作者建议,不论病理如何,不需要活检,LITT就可以实施。较近完成的对SRS(立体定向放射外科)-LAASR(立体定向放射外科后激光消融术)后再生长的病变的前瞻性LITT多中心研究,然而,却与这种方法相抵触。LAASR(立体定向放射外科后激光消融术)的结果表明,虽然6个月时放射性坏死病变的局部控制率为全切,只有74%的肿瘤病例得到控制。这项研究证实LITT是放射性坏死(RN)的一种的微创治疗的选择,但是也建议进行活检以确认病理。
图4。放射性坏死(RN)激光间质热疗(LITT)的成像结果。SRS 治疗6个月后,钆剂后(上)和FLAIR(下)MRI。b.SRS后11个月,FLAIR容积增加伴有症状。C。LITT术后两周显示在病变大小发生改变前,FLAIR容积减少。D,LITT后18个月。
结论
关于放射性坏死(RN)还有很多需要学习。已知放射性坏死是在高剂量照射大脑,被认为是免疫介导的对血管和神经胶质损伤的反应,并因为SRS治疗和免疫治疗以及靶向治疗而不是化疗正在越来越多地用于脑转移瘤的治疗,有可能增加发病率。不管使用SRS治疗较初的理由是什么,有很多合适的选择适用于放射性坏死的治疗。通过合适治疗,预期寿命可以年计。然而,更好地理解放射性坏死的病理生理学,有希望在未来能让医生完全避免放射性坏死的发生。
参考资料:Stephanie K. Cheok Veronica L. Chiang《Adverse Radiation Effects》2019.
- 文章标题:放疗后脑坏死的现状和咨询困境
- 更新时间:2021-04-07 11:37:44

 400-029-0925
400-029-0925