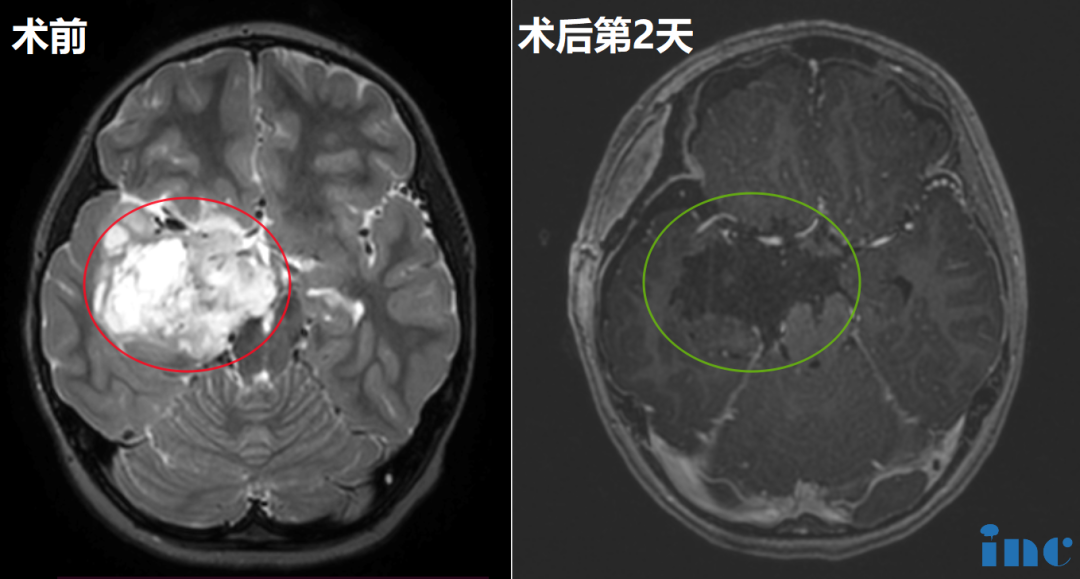
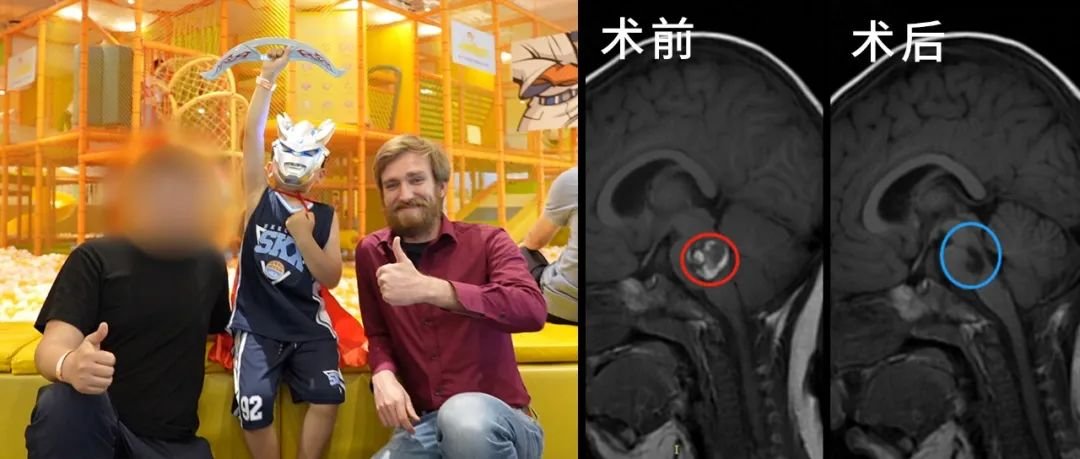
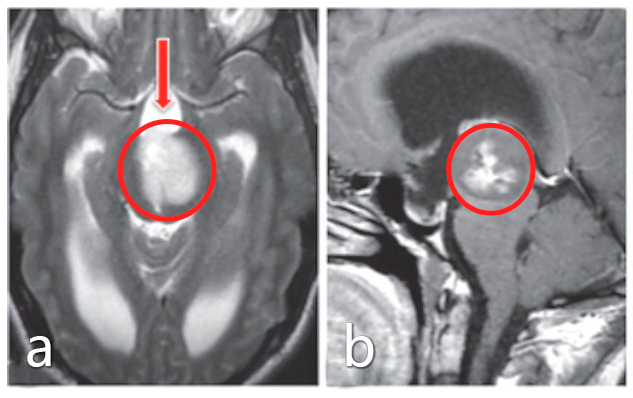
在神经外科领域,脑膜瘤犹如隐藏在大脑中的 “神秘房客”,常常悄无声息地生长。许多人在体检或因其他症状检查时,才意外发现它的存在。面对这一疾病,人们往往充满疑惑:脑膜瘤有几种类型?手术方式?复发率高吗? 理解脑膜瘤的生物学本质、精准分型、治疗路径选择背后的逻辑,以及影响复发风险的关键因素,是拨开迷雾、做出明智决策的基石。
“脑膜瘤”相关阅读:脑膜瘤治疗:原则、费用、最佳治疗方法、几种治疗方案方法
脑膜瘤并非单一疾病实体,其行为谱系宽广——从终生静默的“旁观者”到顽固复发的“挑战者”。手术,通常是治疗的基石,其策略的制定犹如神经外科的精密导航,需考虑肿瘤的“地理位置”、与关键神经血管结构的“邻里关系”及其内在的“性格特征”。而复发风险,则是一个复杂的概率方程,由肿瘤自身的分子蓝图、手术的彻底程度以及可能追加的辅助治疗共同书写。
一、 脑膜瘤分型:超越良恶的生物学行为谱系
世界卫生组织(WHO)分级系统是理解脑膜瘤临床行为的核心框架,它基于肿瘤在显微镜下的组织学特征(细胞形态、生长活跃度、侵袭性等)将脑膜瘤分为三级,每一级预示着不同的生长速度、复发倾向和临床管理策略:
WHO 1级 (Grade I):良性脑膜瘤
占比: 最常见,约占所有脑膜瘤的 70-80%。
特点: 生长极其缓慢,细胞形态接近正常蛛网膜帽细胞,核分裂象(细胞增殖的标志)极少或没有。肿瘤边界通常清晰,压迫而非侵袭性浸润周围脑组织。
常见亚型(举例):
- 脑膜内皮型脑膜瘤: 细胞呈片状、合体样排列,是最常见的亚型。
- 纤维型/成纤维型脑膜瘤: 富含胶原纤维束,细胞呈梭形。
- 过渡型脑膜瘤: 兼具脑膜内皮型和纤维型特征。
- 砂粒体型脑膜瘤: 含有大量钙化的砂粒体。
- 血管瘤型脑膜瘤: 血管结构异常丰富。
- 微囊型脑膜瘤: 形成微小的囊性间隙。
- 分泌型脑膜瘤: 产生假砂粒体(嗜酸性包涵体),常伴有明显瘤周水肿。
- 富于淋巴浆细胞型脑膜瘤: 大量淋巴细胞和浆细胞浸润,可能与免疫反应有关。
- 化生型脑膜瘤: 包含骨、软骨、脂肪或黄色瘤细胞等间叶组织成分。
临床意义: 多数生长缓慢,部分可能长期稳定甚至偶有缩小。手术全切是主要的治愈性手段,复发率相对较低。 无症状小肿瘤可考虑观察。
WHO 2级 (Grade II):非典型脑膜瘤
占比: 约占所有脑膜瘤的 15-20%。
特点: 生长速度中等,介于良恶性之间。关键诊断标准包括:核分裂象增多(≥4个/10个高倍视野), 或存在以下三项或更多组织学特征中的至少一项:
- 细胞密度增高
- 小细胞成分(核浆比高)
- 核仁显著
- 片状(无结构)生长模式
- 自发性(非医源性)坏死灶。
生物学行为: 具有更强的局部侵袭性潜力(如浸润脑组织或骨组织),即使肉眼全切,复发风险也显著高于WHO 1级肿瘤。
临床意义: 是临床决策的重点和难点。 手术追求最大范围安全切除(Simpson分级 I/II级)至关重要。术后是否需辅助放疗(特别是次全切除后)需个体化评估,复发风险明显增高,需长期密切随访。
WHO 3级 (Grade III):间变性/恶性脑膜瘤
占比: 罕见,约占 1-3%。
特点: 高度恶性,生长迅速,细胞异型性明显(形态怪异、大小不一),核分裂象显著增多(≥20个/10个高倍视野),常呈现类似癌或肉瘤的形态。侵袭性极强,易向脑实质内浸润性生长,也具备远处转移(如肺、肝、骨)的潜能,虽然转移发生率不高。
常见亚型:
- 间变型/恶性脑膜瘤: 高度恶性,失去典型脑膜瘤结构。
- 横纹肌样型脑膜瘤: 含有横纹肌样细胞(胞浆丰富嗜酸性、核偏位)。
- 乳头状型脑膜瘤: 形成乳头状结构,好发于儿童,侵袭性强。
临床意义: 预后差。即使积极治疗(手术+放疗±化疗),复发率极高,生存期显著缩短。治疗目标是尽可能延长无进展生存期和总生存期,需要多学科协作制定综合治疗方案。
重要补充:分子分型
随着研究的深入,分子特征(如基因组改变:NF2基因缺失/突变、TRAF7、AKT1、KLF4、SMO、POLR2A等基因突变;甲基化谱)在预测脑膜瘤行为、复发风险和治疗反应方面展现出越来越重要的价值,未来可能更精细地指导个体化治疗。

二、 脑膜瘤手术方式:一场与位置和解剖的精准博弈
手术切除是绝大多数有症状或生长的脑膜瘤的首选治疗方式,目标是在保护神经功能的前提下实现最大范围的安全切除。神经外科医生需根据肿瘤的位置、大小、与周围神经血管结构的毗邻关系、供血情况以及患者的全身状况来选择最佳手术入路。没有一种入路适合所有脑膜瘤。
开颅手术 : 最常用
原理: 在颅骨上打开一个骨窗,直接显露肿瘤。
入路选择(高度依赖肿瘤位置):
- 凸面脑膜瘤: 位于大脑半球表面。入路相对直接(如额颞、顶枕开颅),全切率高,效果通常较好。
- 矢状窦旁/大脑镰旁脑膜瘤: 附着于上矢状窦或大脑镰。关键挑战在于处理肿瘤与静脉窦的关系。若肿瘤已完全阻塞窦腔且侧支循环良好,可考虑连同受累窦壁切除;若窦腔通畅或部分通畅,需谨慎处理以防致命性静脉梗塞,常残留少量附着于窦壁的肿瘤。
- 蝶骨嵴脑膜瘤:内1/3: 毗邻视神经、颈内动脉、海绵窦。手术风险高(视力损害、颈内动脉损伤、动眼神经麻痹等),常采用翼点入路或眶颧入路扩大显露。侵犯海绵窦部分常难以全切;中1/3: 相对风险较低;外1/3: 风险更低。
- 嗅沟/鞍结节脑膜瘤: 位于前颅窝底中线,可压迫视神经、视交叉导致视力视野障碍,侵犯嗅神经导致嗅觉丧失(常被忽视)。常用额下入路(单侧或双侧) 或额外侧入路。需注意保护大脑前动脉、视神经、下丘脑。
- 中颅窝底/鞍旁脑膜瘤: 可侵犯海绵窦、Meckel腔。颞下入路或眶颧入路常用。海绵窦内操作风险极大。
后颅窝脑膜瘤:
- 桥小脑角区 (CPA)脑膜瘤: 需与听神经瘤鉴别。常用乙状窦后入路,需保护面听神经、三叉神经、后组颅神经及脑干、小脑前下动脉。
- 岩斜区脑膜瘤: 最具挑战性的位置之一。位于脑干腹侧,深在,毗邻几乎所有重要的颅神经、基底动脉及其分支。常用乙状窦前入路(经岩骨)、远外侧入路或联合入路。手术时间长,风险高(颅神经损伤、脑干损伤、血管损伤致卒中等),全切率低,致残率高。追求全切常需付出高昂的神经功能代价。
- 枕骨大孔区脑膜瘤: 压迫延髓和高位颈髓。远外侧入路是标准选择,需保护椎动脉、后组颅神经、脊髓。
- 脑室内脑膜瘤: 少见,侧脑室三角区最常见。需经皮层或胼胝体入路进入脑室。
手术关键技术与辅助:
- 神经导航 (Neuronavigation): 术前影像与术中实时匹配,精确定位肿瘤及周围结构,规划最佳入路和切除范围。
- 术中神经电生理监测 (IONM): 持续监测运动、感觉、颅神经功能(如面神经、听神经、后组颅神经),在操作可能损伤神经时及时预警。
- 术中超声/荧光造影: 辅助定位深部肿瘤、判断切除范围及血供。
- 显微外科技术: 在高倍显微镜下精细操作,是减少副损伤的核心。
- 控制出血: 脑膜瘤血供丰富,术前栓塞主要供血动脉(如脑膜中动脉)可显著减少术中出血。术中需耐心处理肿瘤附着基底(血供来源)和瘤内血管。
- Simpson 分级: 衡量手术切除程度的经典标准(I级:全切肿瘤及附着硬膜及异常骨质;II级:全切肿瘤及电凝附着硬膜;III级:全切肿瘤,未处理硬膜附着;IV级:次全切除;V级:单纯减压/活检)。级别越高,复发风险越低(尤其对WHO 1-2级)。
内镜经鼻手术 :
适用部位: 主要适用于颅底中线区域的脑膜瘤:
- 嗅沟脑膜瘤(尤其后部)
- 鞍结节/蝶骨平台脑膜瘤
- 部分累及海绵窦内侧壁的蝶骨嵴内侧脑膜瘤
- 岩斜区脑膜瘤(内侧型)
- 部分枕骨大孔腹侧脑膜瘤
原理: 通过自然鼻腔通道,在内镜引导下磨除颅底骨质,直接抵达肿瘤腹侧。
优势: 无外部切口,避免牵拉脑组织,对脑组织扰动小;对中线腹侧肿瘤提供直接视野。
挑战: 学习曲线陡峭;需要处理脑脊液漏风险(需多层严密修补);对肿瘤包裹血管或侧方延伸处理受限;术后鼻腔护理要求高。
手术策略选择的核心原则
在追求最大安全切除(尽可能达到Simpson I/II级)与保护神经功能/生活质量之间寻求最佳平衡点。 对于复杂位置(如岩斜区、海绵窦)或包裹重要血管神经的肿瘤,次全切除(Simpson III/IV级)结合术后辅助放疗通常是更明智的策略,以避免灾难性的神经功能损伤。

三、 脑膜瘤复发风险:一个动态演变的概率模型
“脑膜瘤会复发吗?”——这是萦绕在患者心头最沉重的问题之一。复发风险绝非固定不变,而是由多重动态因素交织决定的复杂概率:
WHO分级(最强预测因子):
WHO 1级: 复发率最低。大体全切(Simpson I/II级)后,5年复发率约5-10%,10年复发率约10-20%。 部分生长极其缓慢的小肿瘤甚至可长期观察。
WHO 2级 (非典型): 复发风险显著升高。 即使达到Simpson I/II级切除,5年复发率可达30-40%,10年复发率高达50-70%甚至更高。 次全切除后复发几乎是必然的,且时间更短。
WHO 3级 (间变/恶性): 复发风险最高,且生长迅速。 即使联合手术、放疗、化疗,中位无进展生存期(PFS)常不足5年,5年复发率可达70-80%以上。 远处转移风险也存在。
手术切除程度 (Simpson分级):
- 对于任何级别的脑膜瘤,切除越彻底(Simpson I/II级),复发风险越低。
- 残留肿瘤组织(尤其是附着基底部的硬膜)是复发的“种子”。 Simpson III/IV级切除的复发风险远高于I/II级,且复发时间提前。
- 在关键功能区或包裹重要结构时,牺牲功能追求Simpson I级切除得不偿失。此时,Simpson III/IV级切除+辅助放疗可能是更优选择。
肿瘤位置:
- 位置深在、毗邻结构复杂(如岩斜区、海绵窦、矢状窦后1/3、枕骨大孔)的肿瘤,由于手术显露困难、难以彻底切除附着基底或避免损伤关键神经血管,即使组织学良性(WHO 1级),实际复发风险也高于同级别的凸面脑膜瘤。
- 凸面、大脑镰旁(非窦汇区)等位置相对表浅的肿瘤,全切相对容易,复发风险相对较低(符合其分级预期)。
组织学亚型与分子特征:
- 即使同为WHO 1级,某些亚型(如微囊型、分泌型)可能更易引起瘤周水肿或相对活跃。
- 某些分子标志物(如TERT启动子突变、CDKN2A/B缺失、特定的甲基化谱)已被证明是独立于WHO分级的不良预后因素,提示更高的增殖活性和复发风险,即使组织学形态看起来是低级别。
增殖活性标志物:
- Ki-67/MIB-1 增殖指数: 反映肿瘤细胞增殖活跃程度。指数越高(尤其在WHO 2级中>5-7%,在WHO 1级中>3-5%),通常提示更高的复发风险。
- 有丝分裂计数:是WHO分级的关键依据之一。
辅助治疗的应用:
- 放疗(放射外科SRS/分割放疗EBRT): 对于WHO 2级次全切除后、WHO 3级、或复发无法手术的WHO 1-2级脑膜瘤,放疗能显著延缓肿瘤再生长或复发,提高局部控制率。新辅助放疗有时用于缩小巨大肿瘤以利于手术。
- 药物治疗: 目前尚无获批的特效靶向药物或化疗方案。抗血管生成药物(如贝伐珠单抗)可能对控制复发或难治性脑膜瘤(尤其伴显著水肿者)有一定姑息效果。激素受体(孕激素受体)阳性者可能尝试激素治疗(如米非司酮),但证据有限。多种分子靶向药物(针对AKT1、SMO、NF2通路等)处于临床试验阶段。
复发的时间窗:
良性脑膜瘤(WHO 1级)复发可能在术后数年甚至十多年才出现;
非典型(WHO 2级)复发常在术后3-5年内显现;
恶性(WHO 3级)复发通常很快,常在术后1-2年内甚至更早。
结语:个体化导航下的长期管理
脑膜瘤的诊疗,本质上是一场基于精密分型、解剖挑战和复发风险预测的个体化医疗实践。从初次诊断开始,决策就应综合考虑:
- 肿瘤特性: WHO分级、分子特征、位置、大小、症状。
- 患者因素: 年龄、全身状况、神经功能基线、治疗期望(如功能保全优先)。
- 治疗目标: 是追求潜在治愈(低级别、可全切),还是长期控制(高级别、复杂位置),或是缓解症状改善生活质量(高龄、多发合并症)。
- 治疗手段的权衡: 手术入路的选择(开颅 vs. 内镜;具体入路)、切除范围的设定(激进全切 vs. 安全次全切)、辅助放疗的时机与方式。
手术的成功,不仅是影像上肿瘤的消失,更是神经功能的完好无损和生活质量的维系。 对于WHO 1级全切的患者,长期规律随访(通常间隔逐渐延长)是必要的安心保障。对于WHO 2-3级或次全切的患者,随访需更密切(如每3-6个月至数年不等),并积极考虑辅助放疗。复发并非治疗的终点,而是治疗策略调整的节点,仍可考虑再次手术、放疗、药物或联合治疗。
理解脑膜瘤的“类型密码”,敬畏其所在位置的解剖“雷区”,洞悉影响其“是否归来”的深层因素,医患携手制定个体化策略并坚持长期随访管理,方能在这场与“大脑守护者”衍生出的异常组织的博弈中,最大程度地守护神经系统的安宁与生命的质量。每一次随访影像的对比,都是对治疗策略的验证和对未来风险的重新评估,这是一场需要耐心、智慧和持续沟通的旅程。
- 文章标题:脑膜瘤有几种类型?手术方式?复发率高吗?
- 更新时间:2025-07-01 16:23:58

 400-029-0925
400-029-0925