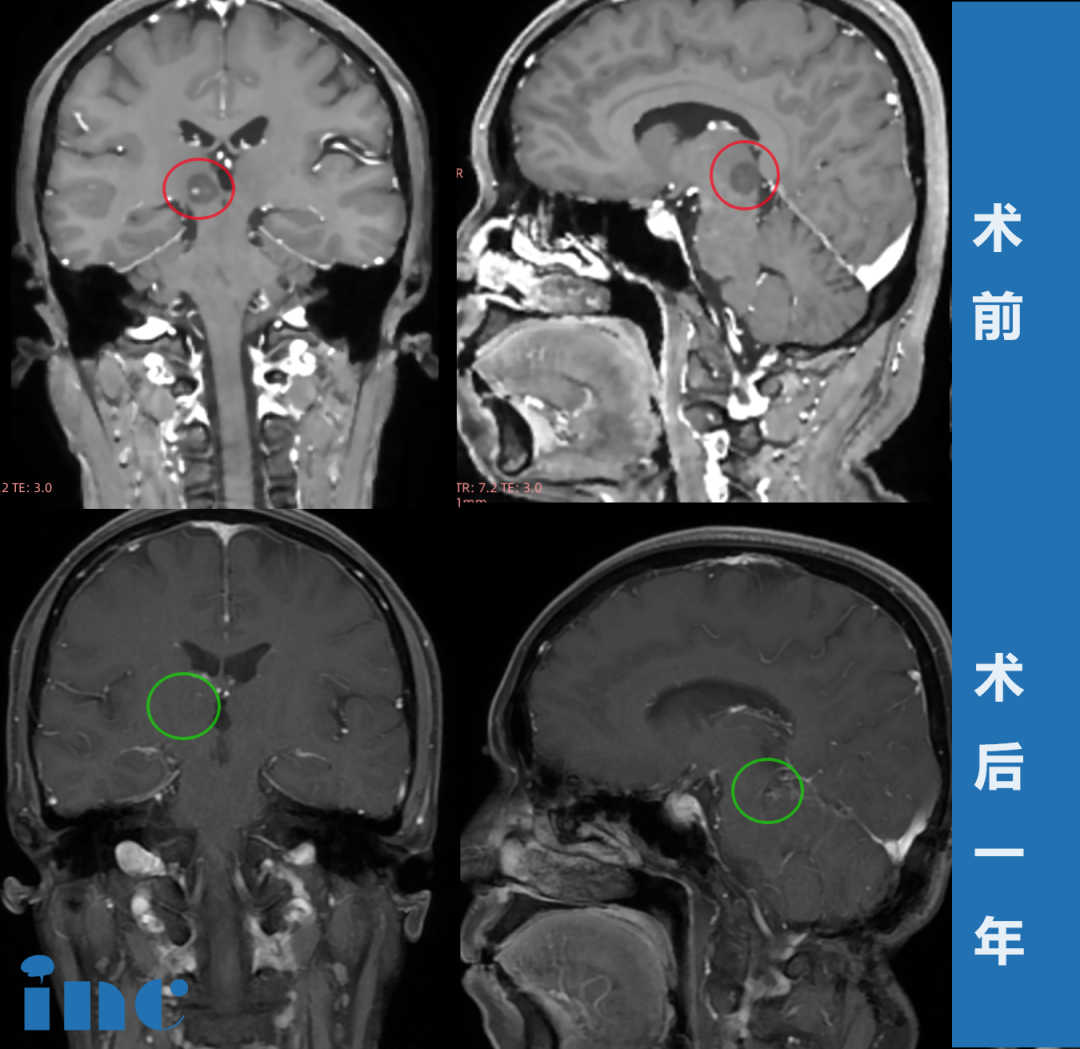
INC国际儿童脑瘤大咖、世界小儿神经系统专业杂志《Child´s Nervous System》现任主编Concezio Di Rocco教授发表研究《ADAR2-editing activity inhibits glioblastoma growth through the modulation of the CDC14B/Skp2/p21/p27 axis》(ADAR2编辑活性通过调控CDC14B/Skp2/p21/p27轴抑制胶质母细胞瘤生长),以下是研究简述。
01
PART
研究摘要
IV级星形细胞瘤(多形性胶质母细胞瘤,GBM)是人类最具侵袭性和致死性的肿瘤之一。ADAR2介导的A→I RNA编辑是脑组织必需转录后修饰事件,但在GBM及星形细胞瘤细胞系中显著受损,其功能尚未阐明。本研究证实,在星形细胞瘤中恢复ADAR2编辑可阻止体内肿瘤生长,并调控GBM中常失调的Skp2/p21/p27细胞周期通路。ADAR2脱氨酶活性为抑制肿瘤生长所必需。我们首次发现磷酸酶CDC14B是该通路的上游关键新型ADAR2靶基因:ADAR2对CDC14B前体mRNA的编辑提高其表达,进而降低Skp2蛋白水平,该机制在体外与体内模型均获验证。与正常脑组织相比,CDC14B的编辑率和表达水平从I级至IV级星形细胞瘤逐渐下降,在GBM中几乎缺失。
综上,
(1)A→I RNA编辑对GBM发病机制至关重要;
(2)ADAR2编辑酶是新型候选抑癌基因;
(3)ADAR2或其底物可作为更安全、有效的GBM治疗新靶点。
02
PART
研究结果
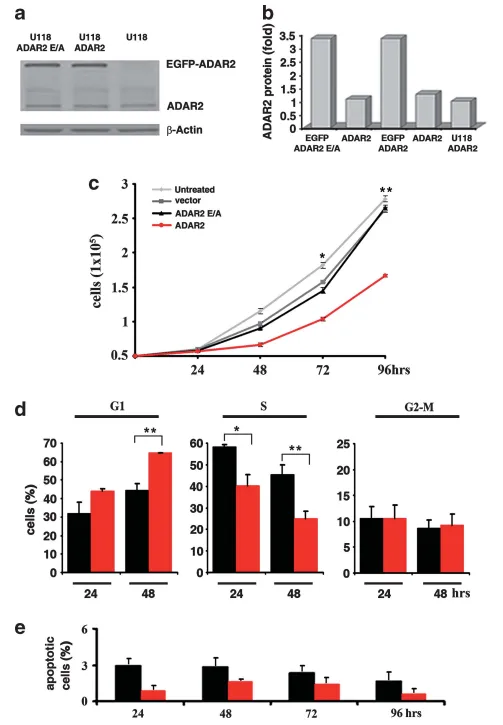
图1 ADAR2编辑活性通过调控细胞周期影响星形细胞瘤细胞增殖
(a)U118亲本细胞、ADAR2过表达细胞及酶失活突变体ADAR2 E/A细胞的总蛋白免疫印迹检测ADAR2表达。
(b)以β-肌动蛋白为内参,相对蛋白表达量以任意单位表示,以内源水平设为1。
(c)5×10⁴U118细胞增殖曲线:未处理(浅灰)、空载体(深灰)、ADAR2(红)及ADAR2 E/A(黑)第1–4天结果。误差条为5次独立实验s.d.,Mean±s.d.(n=5),*P<0.05、**P<0.01 vs ADAR2 E/A。
(d)5×10⁴细胞BrdU/PI双标记流式周期分析(FACSCanto II):ADAR2(红)与ADAR2 E/A(黑)接种后24–48 h示例。Mean±s.d.(n=3),*P<0.05、**P<0.01;采用Click-iT EDU试剂盒获一致结果。
(e)5×10⁴细胞第1–4天凋亡检测:ADAR2(红)与ADAR2 E/A(黑)。Mean±s.d.(n=3)。
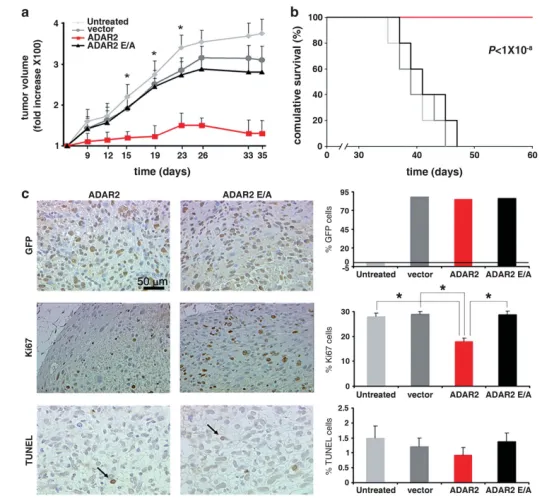
图2 ADAR2编辑活性抑制星形细胞瘤体内生长
(a)2.5×10⁶U118亲本、空载体、ADAR2及ADAR2 E/A细胞肿瘤生长曲线。肿瘤体积以首次测量值(设为1)的倍数表示(y轴),x轴为注射后天数。Mean±s.d.(n=20),**P<0.01 vs ADAR2 E/A肿瘤。
(b)上述各组小鼠的Kaplan–Meier累积生存曲线。
(c)注射后15 d(指数生长期)取瘤行免疫组织化学:左图示代表性视野,分别用抗-GFP、抗-Ki67及TUNEL染色(箭头示凋亡细胞);右图示U118未处理(浅灰)、空载体(深灰)、ADAR2(红)及ADAR2 E/A(黑)肿瘤中GFP、Ki67、TUNEL阳性细胞百分比。Mean±s.d.(n=10),**P<0.01。
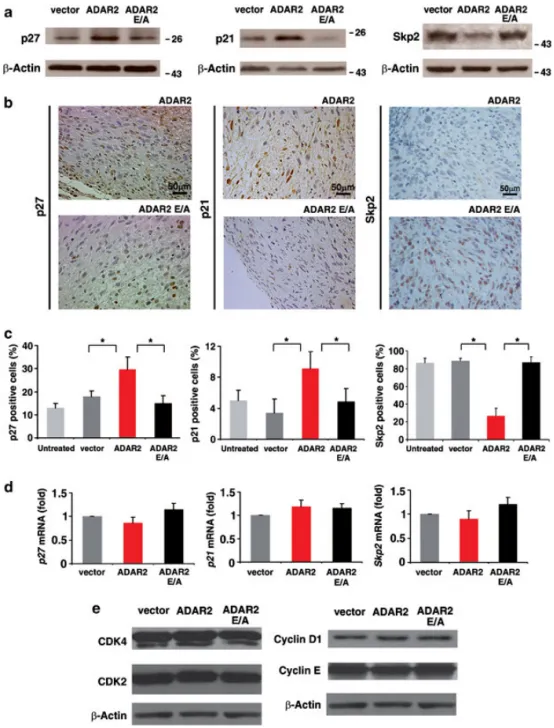
图3 ADAR2表达对p27/p21/Skp2通路的体内外分析
(a)空载体、ADAR2及ADAR2 E/A细胞总蛋白的p27、p21、Skp2免疫印迹。
(b)15天移植瘤免疫组化:ADAR2与ADAR2 E/A肿瘤代表性视野(p27、p21、Skp2染色)。
(c)移植瘤(15天)IHC阳性细胞百分比:未处理U118(浅灰)、空载体(深灰)、ADAR2(红)、ADAR2 E/A(黑)。Mean±s.d.(n=10),**P<0.01。
(d)qRT–PCR检测上述细胞系p27、p21、Skp2 mRNA水平。Mean±s.d.(n=4)。
(e)空载体、ADAR2、ADAR2 E/A细胞总蛋白的CDK4、CDK2、Cyclin D1、Cyclin E免疫印迹。
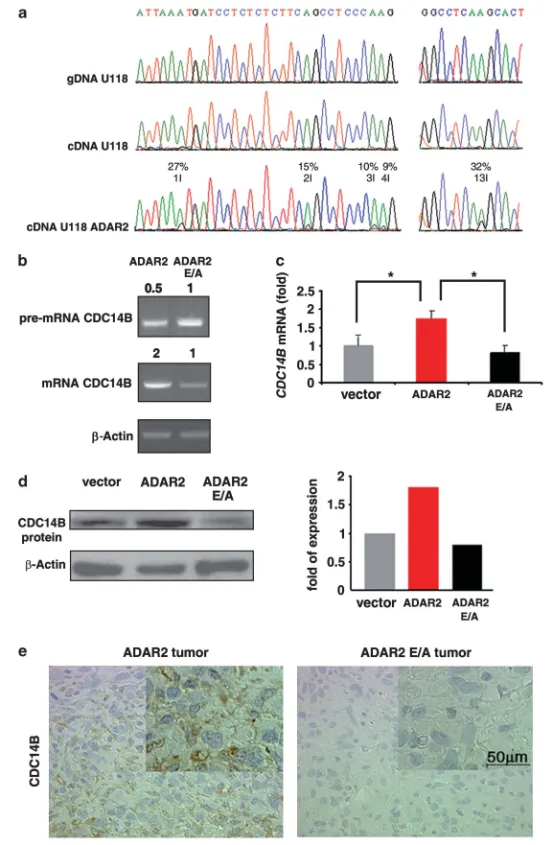
图4 ADAR2介导的RNA编辑在体内外调控CDC14B表达
(a)U118基因组DNA(gDNA)、U118亲本cDNA及U118-ADAR2 cDNA中CDC14B内含子7–8区域测序色谱图。编辑位点(1–4I、13I)呈A(绿)与G(黑)双峰,右侧标注编辑率。
(b)半定量RT–PCR检测CDC14B前体mRNA与成熟mRNA:ADAR2 vs ADAR2-E/A,表达量以ADAR2-E/A设为1的相对倍数表示,β-肌动蛋白内参,引物见附表S1。
(c)qRT–PCR检测CDC14B mRNA:空载体、ADAR2、ADAR2-E/A细胞。Mean±s.d.(n=3),*P<0.01。
(d)免疫印迹检测CDC14B蛋白(左)及光密度定量(右)。
(e)ADAR2与ADAR2-E/A移植瘤CDC14B免疫组化代表性视野。
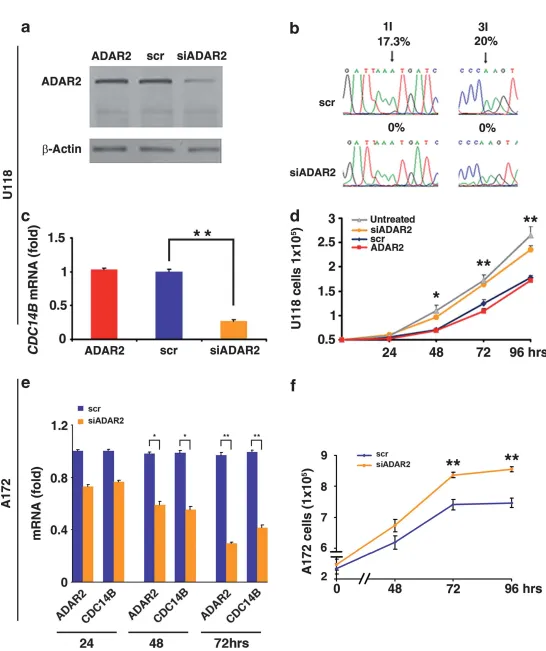
图5 ADAR2编辑上调CDC14B表达并调控细胞增殖
(a)ADAR2-U118细胞及其scramble(scr)或siADAR2稳定转染株的总蛋白ADAR2免疫印迹。
(b)内源性CDC14B转录本测序图,箭头示随机位点编辑率。
(c)qRT–PCR检测CDC14B mRNA:ADAR2、scrADAR2、siADAR2组。Mean±s.d.(n=2),**P<0.01。
(d)增殖曲线:未处理U118、ADAR2、scrADAR2、siADAR2。Mean±s.d.(n=3),*P<0.05、**P<0.01 vs siADAR2。
(e)A172细胞沉默内源ADAR2后24、48、72 h的ADAR2与CDC14B qRT–PCR。Mean±s.d.(n=2),*P<0.05、**P<0.01 vs scrADAR2。
(f)A172 scramble与ADAR2沉默株增殖曲线。Mean±s.d.(n=2),**P<0.01。
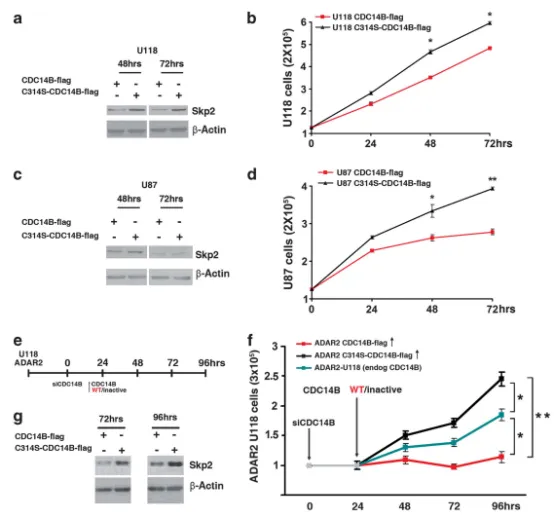
图6 ADAR2介导的CDC14B表达对星形细胞瘤细胞增殖的重要性
(a)U118细胞转染CDC14B-flag或失活突变体C314S-CDC14B-flag后48、72 h的Skp2蛋白Western blot。
(b)对应增殖曲线;Mean±s.d.(n=2),*P<0.05。
(c)(d)U87细胞重复(a)(b)实验;Mean±s.d.(n=2),*P<0.05,**P<0.01。
(e)“沉默-再表达”策略示意图:ADAR2-U118细胞先稳定沉默内源CDC14B(0 h),24 h后(内源降低约90%)等量转染CDC14B-flag(红)或C314S-CDC14B-flag(黑)。
(f)增殖曲线:沉默内源CDC14B的ADAR2-U118(灰)及再转染CDC14B-flag(红)或C314S-CDC14B-flag(黑)组,以未处理ADAR2-U118(蓝)为对照;Mean±s.d.(n=2),**P<0.01(72、96 h C314S vs CDC14B-flag);*P<0.05(ADAR2-U118 vs两组突变/再表达)。
(g)上述再表达实验中72、96 h的Skp2蛋白Western blot。
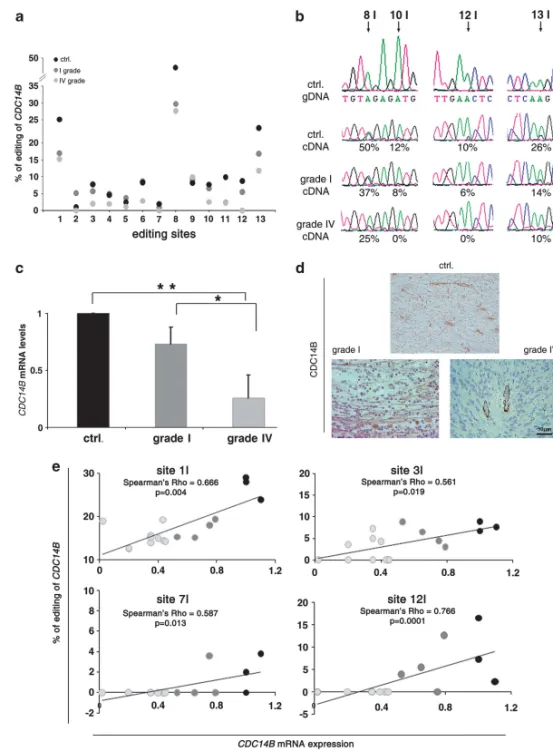
图7 CDC14B转录本在星形细胞瘤与正常脑组织中的编辑率与表达水平
(a)CDC14B内含子7–8 AluJr区域13个编辑位点(1–13I)的编辑百分比:正常脑组织(黑,n=3)、I级(深灰,n=7)与IV级星形细胞瘤(浅灰,n=12)。
(b)代表性测序色谱:白质对照(Ctrl)gDNA(上)及cDNA、I级与IV级肿瘤cDNA;箭头示编辑位点及百分比。
(c)CDC14B mRNA qRT–PCR:正常脑、I级与IV级肿瘤。Mean±s.d.(n=3),*P<0.05,**P<0.01。
(d)CDC14B免疫组化:IV级、I级肿瘤与正常脑(Ctrl);内皮细胞为内参阳性对照(右下)。
(e)各组织CDC14B编辑水平与mRNA表达相关性:正常(黑点)、I级(深灰点)、IV级(浅灰点)标本;示显著相关示例,采用Spearman非参数检验,P<0.05为差异有统计学意义。
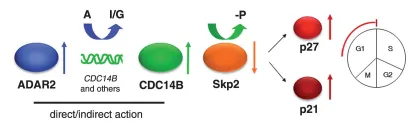
图8 ADAR2在星形细胞瘤细胞增殖中的作用模式图
ADAR2通过(直接和/或间接)促进CDC14B RNA编辑及过表达,驱动CDC14B蛋白升高;CDC14B诱导Skp2降解,进而上调p21与p27,使细胞周期阻滞于G1期,从而抑制增殖。
03
PART
关于作者
小儿神经外科,专注于解决儿童诸多神经外科疾病,诸如脑肿瘤、脑积水、小儿癫痫、先天畸形等,一直被称为难度最大的外科专业之一。Concezio Di Rocco教授曾受到来自法国、埃及、吉尔吉斯斯坦等国家的邀请进行讲座和现场演示,且联合全球知名小儿神外专家创办了儿童神经外科研究所课程。
该项课程在过去30年里为世界培养了无数儿童神经外科医生,包括目前国内若干知名三甲医院的儿童神经外科主任专家,都曾是他的学生。Concezio Di Rocco教授将其领先的治疗技术分享给世界各地儿科神经外科医生进行借鉴参考和学习,为世界儿科神经外科的发展做出了巨大贡献。Di Rocco教授曾到访苏州大学附属儿童医院,为6名神经外科疑难杂症孤儿进行义诊。


Di Rocco教授一生撰写或参与撰写的儿童神经外科部分著作

国际儿童神经外科学会主席(ISPN)(1991-1994年)
世界神经外科联合会教育委员共同主席(2013-2017年)
世界神经外科联合会儿童神经外科委员会主席(2001-2009年)
世界小儿神经系统知名杂志《Child´s Nervous System》现任主编
国际儿童颅底学会主席(创始成员)
世界神经外科联合会基金小儿脑积水项目负责人
德国汉诺威国际神经科学研究所儿科神经外科主任(2013年至今)
欧洲神经外科学会(EANS)前副主席
世界神经外科学会联合会(WFNS)儿科委员会曾任主席
罗马天主教大学医学院儿科神经外科学系主任
国际儿童神外专家Concezio Di Rocco教授
自2014年5月起,Di Rocco教授就担任了德国汉诺威国际神经科学研究所(INI)的儿科神经外科主任。从事儿童神外事业50余年,Di Rocco教授尤为擅长小儿神经纤维瘤、癫痫、脑积水、蛛网膜囊肿、颅缝早闭、脑和脊髓肿瘤、脑和脊柱畸形(半椎体畸形,皮质发育不良,脊髓脊膜膨出,脊髓内脂肪瘤,Arnold-Chiari畸形等)难治病症方面的治疗,曾进行过12000多次神经外科手术。
- 文章标题:【INC国际大咖研究成果】ADAR2编辑活性通过调控CDC14B/Skp2/p21/p27轴抑制胶质母细胞瘤生长
- 更新时间:2025-10-06 12:09:33

 400-029-0925
400-029-0925