胶质母细胞瘤(GBM)患者的临床管理具有高度复杂性,其治疗方案涵盖标准治疗(包括最大范围安全切除、放射治疗和化学治疗)以及通过临床试验和精准医疗手段实施的新型免疫治疗和靶向小分子抑制剂治疗。
随着治疗手段的进步,GBM患者的影像学与临床评估变得更加复杂且精细。磁共振成像(MRI)空间分辨率的提升及其可提供的解剖与生理信息的扩展,显着改善了治疗前、治疗中和治疗后对GBM的无创评估能力。其中,识别假性进展(PsP)——即影像学上疑似肿瘤进展、实为与治疗反应相关的暂时性改变——对患者的成功管理至关重要。此类暂时性变化可因占位效应和水肿引发新的临床症状。
区分假性进展与真实肿瘤进展是决定患者后续治疗及预后的关键决策点,临床医师可能据此选择启用替代治疗方案、转向临床试验、考虑再次手术切除或维持现有治疗并期待病变自行缓解。
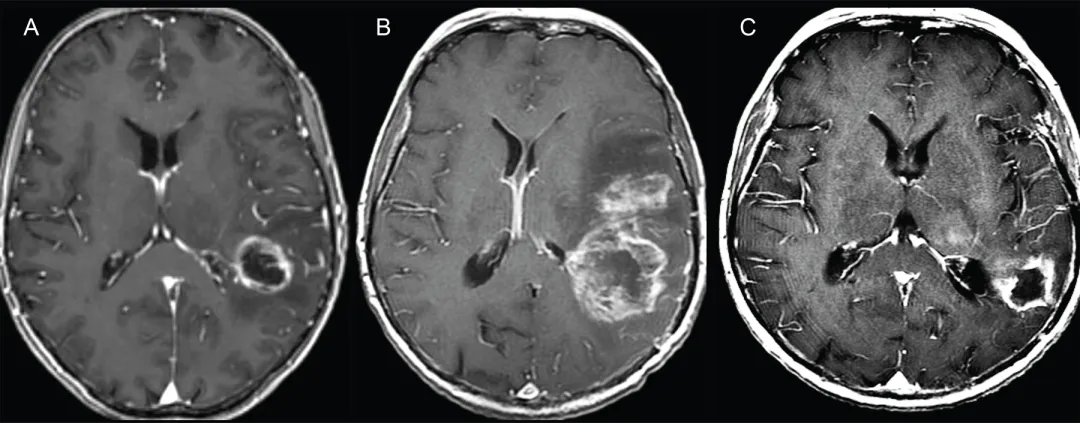
图1.假性进展典型病例
左侧额顶叶GBM轴位T1加权增强MRI图像:
A.活检后、放疗前图像显示左侧额叶后部脑室旁GBM
B.外照射放疗结束后1周图像显示占位效应显着加重,邻近脑室受压
C.放疗结束后3个月图像显示占位范围及占位效应显着消退
INC国际神经外科医生集团旗下组织世界神经外科顾问团(WANG)成员Mitchel S.Berger教授等发表研究《Pseudoprogression versus true progression in glioblastoma:what neurosurgeons need to know》,以下是研究分享。

放射性坏死和假性进展的关系
放射性坏死作为假性进展谱系中的类似治疗相关反应,通常发生于放疗后6-18个月,预估发生率为6%-25%。虽然两者病理生理机制均涉及血管损伤及后续毛细血管渗漏,但放射性坏死通常还累及肿瘤细胞周围的瘤周白质。假性进展可能是放射性坏死的前期表现,属于早期炎症反应伴血管通透性增加及后续对比剂强化。这两种情况均具有重要临床意义,因其均可引发症状并干扰真性肿瘤进展的准确诊断。

“真进展”VS“假进展”
系列MRI检查是监测GBM疾病状态的主要手段。细胞毒性化疗、放疗及免疫治疗均可改变肿瘤的形态学与生理学特征,这种改变既可发生于辅助治疗期间,也可出现在治疗结束后的短期与长期阶段。因此,单纯依靠常规解剖成像序列评估疗效价值有限。对复发患者实施再次手术、再程放疗、补充化疗、抗血管生成治疗(贝伐珠单抗)或免疫治疗,进一步增加了随访影像解读的复杂性。
磁共振成像技术在鉴别诊断中的应用
除传统T1、T2解剖序列外,其他磁共振成像序列有助于鉴别假性进展与真性进展——DSC、ASL、PET等。采用脑血容量作为灌注参数是识别真性进展的方法之一(图2、3),真性进展通常表现为血管化增加与灌注升高,而假性进展因其炎症病理生理机制常显示最小灌注相关改变。
动态磁敏感对比灌注成像
动态磁敏感对比灌注成像(DSC)是测量脑血容量的常用方法,可准确识别真性进展。汇总分析显示其诊断比值比为57(95%置信区间12-268),敏感度与特异度分别为84%与78%。尽管存在对对比剂经破坏的血脑屏障渗漏的担忧,但采用先进校正技术可克服此缺陷。
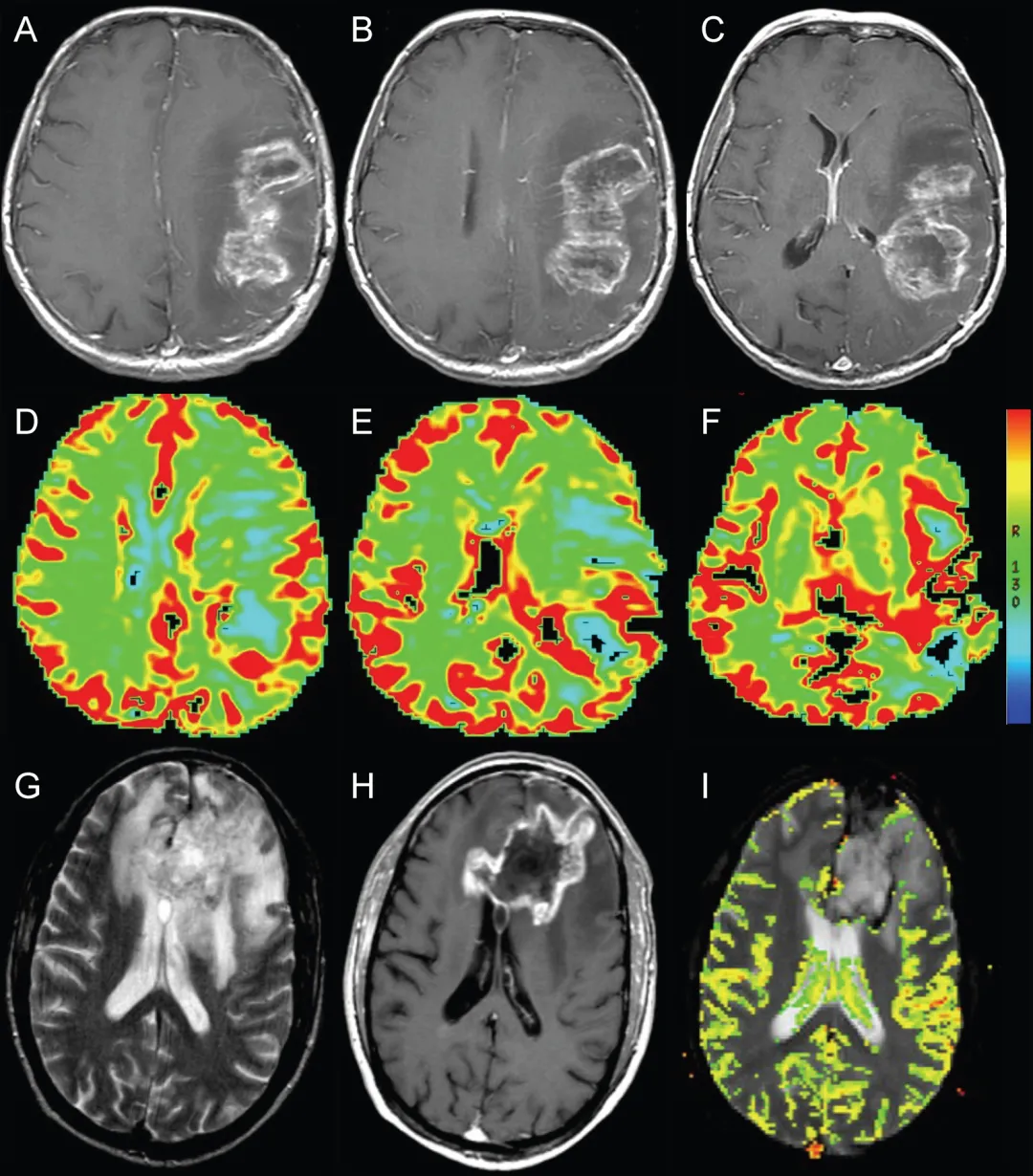
图2.动态磁敏感对比灌注成像辅助鉴别假性进展。A-C:左侧额顶叶胶质母细胞瘤放疗后即刻轴位T1加权增强MRI,显示环形强化坏死性占位伴周围水肿及占位效应(与图1为同一患者)。D-F:轴位动态磁敏感对比灌注图像显示强化病灶后缘血容量轻度增加(箭头所示)。G:轴位T2加权MRI显示放疗后左侧额叶环形强化坏死性占位周围显着水肿,疑似肿瘤复发。H:轴位T1加权增强MRI显示结节状环形强化占位伴坏死。I:轴位动态磁敏感对比灌注图像未见血容量升高,符合假性进展病理诊断
动脉自旋标记成像
动脉自旋标记成像(ASL)可能成为鉴别胶质瘤真性进展与治疗反应的有效替代方法,因其无需使用对比剂且对磁敏感伪影敏感性较低。前瞻性研究报道其诊断能力与动态磁敏感对比成像相当,而动脉自旋标记测得的脑血流量可准确识别IDH突变,显示其独特附加价值。汇总分析表明真性进展组的动脉自旋标记测量脑血流量、相对脑血流量及相对脑血容量均显着更高,报道的平均敏感度与特异度分别为94%与50%。
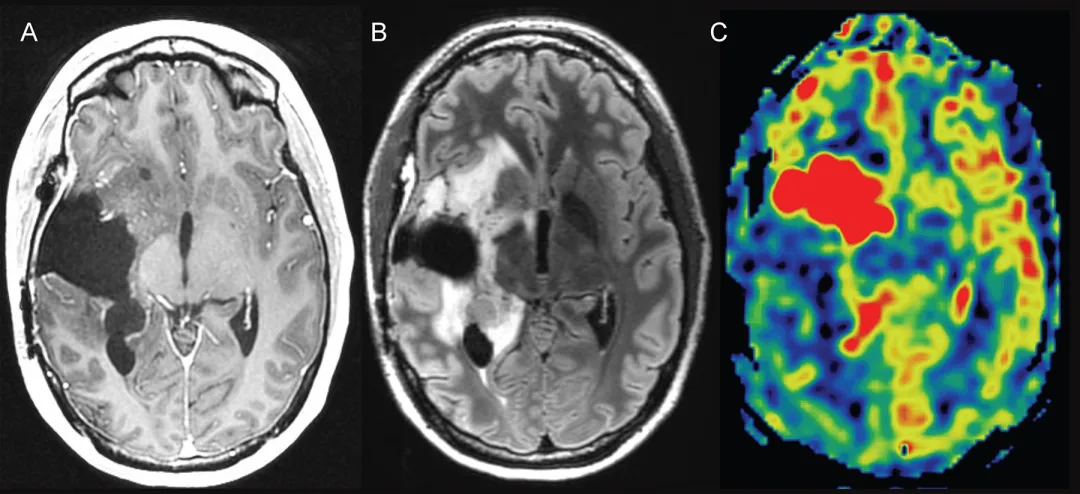
图3.动脉自旋标记灌注成像辅助鉴别真性进展。右侧岛叶胶质母细胞瘤放疗后1年—A:轴位T1加权增强MRI显示右侧基底节区切除腔前缘斑点状微弱强化。B:轴位FLAIR图像显示切除腔周围非特异性高信号异常。C:轴位动脉自旋标记灌注图像显示血流量显着增加,针对此区域的再次切除术证实广泛肿瘤复发。
磁共振波谱成像
磁共振波谱成像(MRS)作为体素内代谢物标记的无创手段,也可辅助诊断真性进展(图4)。脑血容量与磁共振波谱方法的汇总分析显示,与假性进展相比,真性进展组的胆碱/N-乙酰天冬氨酸比值与胆碱/肌酸比值显着升高。确定合适截断值存在挑战,有研究报道采用对侧脑组织胆碱/胆碱比值的敏感度低至33%,而其他研究报道敏感度与特异度均超过90%。此外,在强化区域内,对侧脑组织肌醇/肌酸比值降低与乳酸/谷氨酰胺+谷氨酰胺比值升高均与真性进展相关。磁共振波谱的局限性还在于其对异常区域体素定位的依赖,根据磁共振场强差异,获得足够信噪比所需的体素尺寸为1-8立方厘米,限制了该技术检测微小病灶变化的能力。尽管磁共振波谱单独诊断效能因技术限制存在差异,但联合扩散/灌注加权成像可提高整体准确性已达成共识。
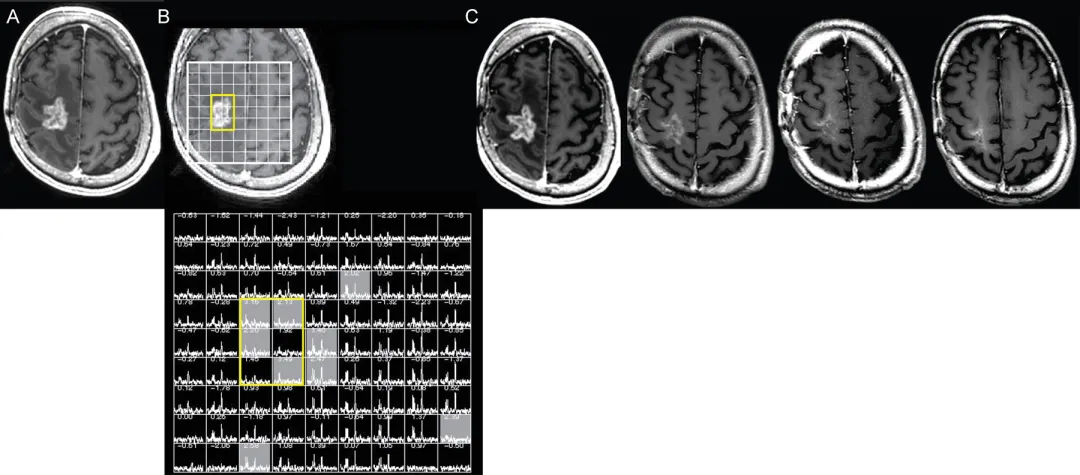
图4.磁共振波谱辅助判定假性进展。右侧额叶胶质母细胞瘤放疗后12个月疑似复发—A:轴位T1加权增强MRI显示结节状环形强化占位伴坏死。B:病变三维质子磁共振波谱显示N-乙酰天冬氨酸与胆碱显着降低(黄色轮廓),提示治疗相关改变而非肿瘤复发。C:连续8个月的四幅轴位T1加权增强MRI显示强化病灶进行性缩小,治疗未改变。
化学交换饱和转移
化学交换饱和转移(CEST)是另一种磁共振代谢物分析方法,常与酰胺质子转移技术联用,以量化比较脑组织内源性蛋白质水平。较高水平的蛋白质反映更强的代谢活性,可能有助于鉴别真性进展与假性进展。然而此类新技术数据有限,临床应用前需开展更大规模队列研究。
影像组学
传统与先进磁共振序列结合机器学习技术(称为影像组学)可为影像判读增加定量分析维度。该技术能整合多种诊断技术与模式,在鉴别真性进展与假性进展方面,影像组学分析显示复发性胶质母细胞瘤质地更实,若进展发生于放化疗结束后12周后,强化肿瘤形态也更趋球形。影像组学模型可纳入复发位置、强化体积等特征,部分方法在鉴别两者方面展现潜力,采用组织病理学验证的研究中诊断准确率高达87%。近期荟萃分析支持该结论,汇总敏感度与特异度分别为95.2%与82.4%,发现采用深度学习或机器学习方法结合先进磁共振技术优于传统序列(诊断比值比6.55,95%置信区间1.29-33.27,p=0.03)。影像组学可消除影像判读的观察者间差异,但扫描参数与成像流程的差异可能限制其机构间普适性。尽管影像组学在当前临床实践中应用尚不普遍,但未来广泛实施的可能性正逐步增加。
正电子发射断层扫描(FET)
正电子发射断层扫描已成为另一种重要的影像学手段,其通过使用放射性标记的氨基酸示踪剂(如O-(2-[¹⁸F]氟乙基)-L-酪氨酸、3,4-二羟基-6-¹⁸F-氟-L-苯丙氨酸或¹⁸F-氟代脱氧葡萄糖;图5)来识别代谢活跃的肿瘤区域。该技术基于肿瘤细胞糖酵解过程中代谢活性增强及氨基酸摄取增加的特性。由于脑部PET扫描存在本底活性低的固有局限性,FET可能优于FDG。最新研究不仅支持FET的高敏感性与特异性,还证实其能准确指导治疗决策,FDOPA在诊断性活检中同样具有价值。
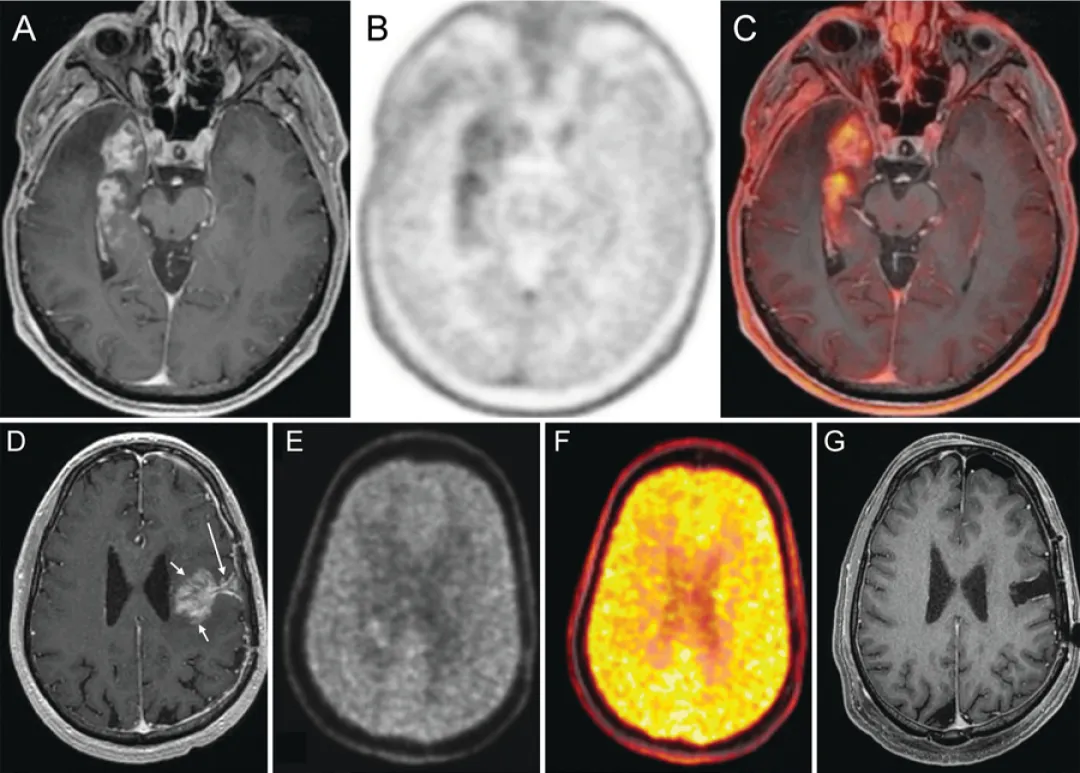
图5.PET在复发判断中的应用案例
A-C:右颞叶GBM放疗后6个月
A:轴位T1增强MRI显示右内侧颞叶占位性强化。B:轴位FDOPA PET显示右颞区代谢摄取增高。C:轴位FDOPA PET-MR融合图像精确显示代谢活性定位于右内侧颞叶占位
D-G:左额叶复发性GBM再程放疗联合免疫治疗后2个月
D:轴位T1增强MRI显示手术切缘深部(长箭头)类肿块强化灶(短箭头),基于此影像行再次切除。E:轴位FDOPA图像显示强化灶内无摄取增高。F:轴位FDOPA伪彩图显示强化灶内无摄取增高。G:再次切除术后1月轴位T1增强MRI显示无残留强化
活检与切除的作用
要明确影像学改变属于真性进展抑或假性进展,必须通过活检或再次切除获取组织。活检可采用开颅或立体定向方式,但取样误差并不少见——尤其在异质性显着的GBM中,准确率可低至76%。更重要的是,若不采用基因测序,其准确率高度依赖肿瘤体积。
尽管如此,对可疑GBM组织的病理学检查可直接观察活肿瘤细胞及相关微环境。例如肿瘤诱导的坏死常为凝固性坏死伴胶质增生、淋巴细胞与巨噬细胞浸润,而化疗则引起白质凝固性坏死与星形胶质细胞增生。需注意复发疾病组织样本很少是100%活肿瘤细胞或100%“治疗反应”,多为两者混合。某些因素如初次手术与再手术间隔较短、未使用贝伐珠单抗、大分割放疗及替莫唑胺治疗与病理检查中治疗反应增强相关,而病灶大小与肿瘤活性无显着关联。
诊断困境在于:组织病理学报告可能因取样部位及神经病理学家差异而不同,其临床价值受到质疑。
结论
假性进展是神经外科医师治疗GBM过程中需要认识的重要临床现象。虽然其发生通常早于真性进展,但临床表现复杂,尤其在疾病后期。迫切需要准确诊断工具进行鉴别。基于先进序列的MRI技术可识别治疗反应的生理与代谢指标;PET成像可揭示代谢活跃肿瘤区域;影像组学有望整合多种影像模式优势……无论采用何种技术,组织确认仍是金标准。
- 文章标题:如何区分胶质母细胞瘤“真进展”和“假进展”?不同影像学技术的作用你知道吗?
- 更新时间:2026-01-01 12:05:06

 400-029-0925
400-029-0925