脑瘤开颅术后复发怎么办?可以做第二次手术吗?
41岁的凯茜没想到胼胝体肿瘤开颅之后,仅仅4年就复发了,而这一次居然全内镜就可以全切肿瘤,术后2年无复发。
INC国际神经内镜大咖施罗德教授擅长利用神经内镜技术与病理状态下的解剖变化相结合,巧妙利用脑积水导致的脑室扩张或肿瘤占位效应形成腔隙,构建出独特的"病理适应性手术空间"。

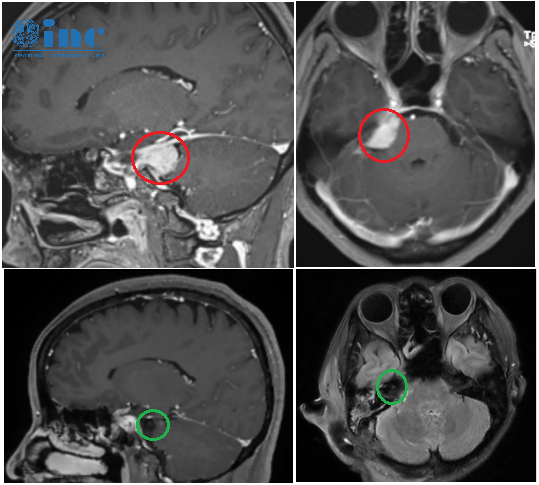
(A,B)磁共振图像显示一个附着于透明隔的病灶。(I,J)术后 2 年磁共振成像显示肿瘤完全切除。
最初,内镜下肿瘤手术仅限于在患者出现肿瘤相关梗阻性脑积水时,于内镜下第三脑室造瘘术后进行活检。随着经验积累,开始实施部分肿瘤切除。最终,利用纯内镜技术,可完全切除某些选定肿瘤。

神经内镜手术是治疗脑室内肿瘤的理想策略。这类肿瘤往往阻塞脑脊液通路引发脑室扩张,恰好为内镜操作提供了天然的手术空间。手术关键在于先精准阻断肿瘤血供,再根据肿瘤特性灵活选择分块切除或整体剥离。
针对不同位置的肿瘤,手术入路需要个性化设计:
- 单侧脑积水时采用偏外侧钻孔以优化室间孔入路;
- 第三脑室前部肿瘤选择冠状缝钻孔,后部肿瘤则需前移入口建立直线通道;
- 对于压迫导水管的松果体区肿瘤,必须同步实施第三脑室造瘘和肿瘤手术。
神经内镜技术的精妙之处在于既能彻底切除肿瘤,又能同步重建脑脊液循环通路,以更小创伤实现更佳治疗效果,尤其对于小型肿瘤可以完全切除。
这种脑室内肿瘤神经内镜就可以全切!
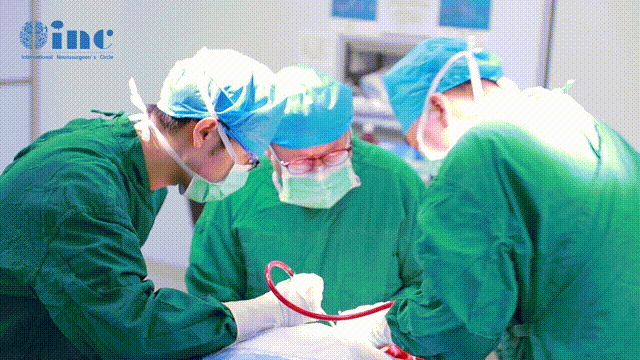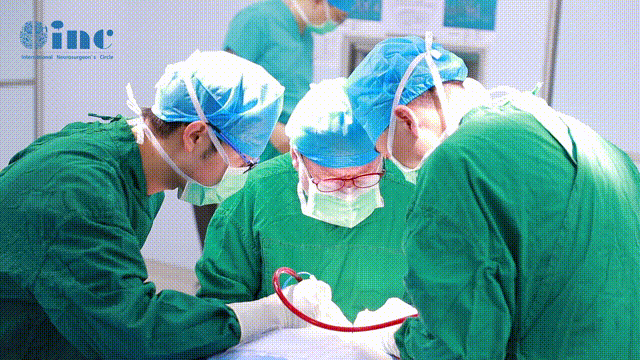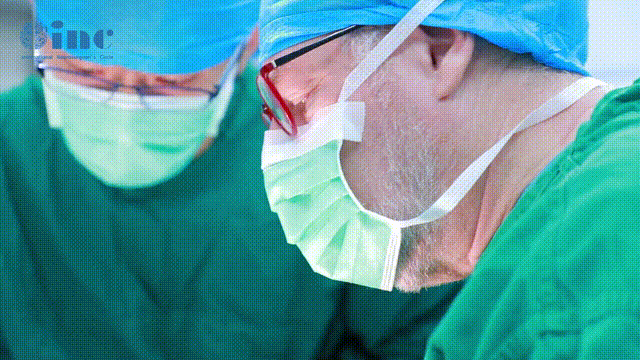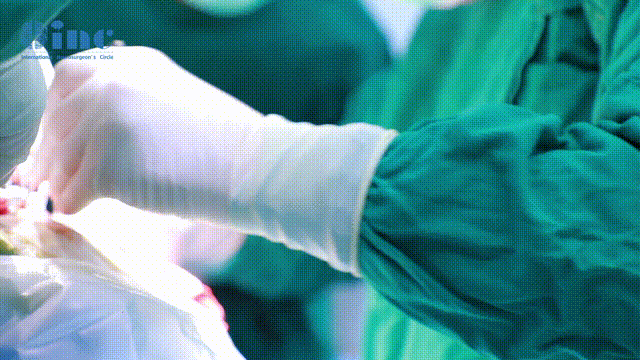
41岁女性,胼胝体肿瘤显微外科手术4年后,随访发现复发性神经细胞瘤。在这则案例中,显微外科手术入路更为复杂、侵入性更强且风险更高。INC国际神经外科医生集团旗下组织世界神经外科顾问团(WANG)成员、世界神经外科学会联合会(WFNS)内镜委员会前主席Henry W.S. Schroeder教授(施罗德教授)因此选择全内镜进行肿瘤切除。
神经细胞瘤是什么肿瘤?
病因与发病机制
细胞起源可能来源于:具有双向分化潜能的神经胶质前体细胞侧脑室室管膜下区室周器官。
遗传学特征
- 无明确复发性染色体改变
- 多数病例基因组拷贝数分析呈二倍体
- 个别报道显示MYCN基因扩增
- WNT信号通路相关基因过表达
- 不伴1p/19q联合缺失
- 目前甲基化分型无法区分典型与非典型中枢神经细胞瘤
预后与预测因素
生存数据:5年总生存率96%,10年总生存率82%。
影响因素
手术切除程度:全切除优于次全切除(但近期研究显示生存率无统计学差异)
增殖活性
- Ki-67(MIB1)标记指数>4%者:2年无进展生存率48%
- Ki-67(MIB1)≤4%者:2年无进展生存率90%
- 高Ki-67指数应考虑辅助治疗(但最佳阈值尚未统一)

内镜切除肿瘤图解
神经导航手术入路规划

(D)附着于透明隔的肿瘤。

(E)在肿瘤边缘附近对透明隔进行电凝。

(F)沿肿瘤周围切割透明隔。

(G)用抓钳切除肿瘤。

(H)肿瘤切除后透明隔的自由边缘。

国际内镜手术大咖施罗德教授手术技术分享

通过脑室系统,内镜可轻松到达这些病变部位。此外,由于脑室内肿瘤常导致脑脊液(CSF)通路梗阻,进而引起脑室扩张,因此为内镜操作提供了充足空间。
即使在脑室狭窄的患者中,借助神经导航也可精准、安全地到达病变部位。内镜在脑室内肿瘤治疗中的目标通常是解除脑脊液通路梗阻、明确组织学诊断,如果可能,还力求完全切除肿瘤。
与显微外科切除相比,内镜入路的优势在于能更好地照亮并清晰显示脑室深处的结构,同时减少对脑组织的分离和牵拉。因内镜可通过简单钻孔插入,故可避免开颅手术。经神经内镜手术中内镜鞘操作可保护周边结构,如胼胝体、下丘脑和血管。
一、复杂精密的设备
在神经内镜手术中,需要一套复杂且精密的设备系统。为了能够完全切除脑室内病变,必须具备较大的工作通道和有效的手术器械。使用小型抓钳和狭窄的工作通道时,很难实现有效的组织切除。
LOTTA脑室镜
脑室镜(Ventriculoscopy)是一种神经外科技术,主要用于脑室内疾病的诊断和治疗。脑室镜技术允许医生在脑室内进行可视化操作,以便对脑室内的病变进行评估和处理。这种技术通常通过小切口进入,利用脑室镜的照明和成像系统,为医生提供清晰的视野,从而能够进行精确的操作。脑室镜技术在神经外科领域具有重要的应用价值,尤其在处理脑室内的肿瘤、出血、感染等问题时,可以通过较小的创伤实现诊断和治疗的目的。
LOTTA具有极高的透光性,即使在蛋白质丰富或混有血液的脑脊液中,也能呈现卓越的图像质量并保持安全的空间定向。自带的 HOPKINS 柱状透镜拥有 6°视角,极大地缩减了视觉盲区,就相当于直接打开了大脑的“房门”走进房间,能把房间的每个角落都看清楚,也就成为了神经外科医生们的一双“ 眼睛 ”。
作为一种全方位解决方案,LOTTA系统提供了灵活的选择:Little LOTTA直径较小,操作更便捷,适用于多种手术,如脑室造瘘术、隔膜造瘘术、肿瘤活检以及囊肿开窗术;而LOTTA尺寸更大,除上述适应症外,还特别适用于胶样囊肿切除、肿瘤切除、支架植入术以及导水管成形术(伴或不伴后续支架置入)。

施罗德教授发明并由国际知名内镜生产企业KART-STORZ生产
二、“干燥视野”、注意止血
在止血方面,需要使用双极电凝探针或镊子。激光也可以作为替代工具,但激光设备成本高昂。由于在内镜肿瘤切除过程中出血较为常见,因此需要持续打水以保持视野清晰。理想的设备是电动流量和压力控制泵。
在需要短时间强力灌注时,可以使用注射器。乳酸林格氏液(温度为36℃–37℃)是首选,因为与大量生理盐水灌注后常见的术后体温升高相比,使用乳酸林格氏液后很少出现这种情况。为了避免颅内压(ICP)危险性升高,必须确保灌注液有足够的流出。在出血情况下,切勿拔出内镜,而应保持原位,进行冲洗并等待。
在肿瘤分离过程中可能受损的较大血管,应在出血发生之前使用双极电凝进行烧灼。在极少数严重出血的情况下,需要抽吸脑脊液(CSF)以获得干燥的手术视野。采用这种“干燥视野”技术,更容易识别出血血管,并能迅速实现止血。
内镜治疗脑内和脑旁肿瘤的总体原则是阻断肿瘤的血液供应,随后进行肿瘤减容。一般来说,采用分块切除的方式;然而,在某些肿瘤中,可以将病变从周围脑组织中分离并完整切除。切除后,仔细止血至关重要,以避免再次出血。
在肿瘤切除后,检查切除部位以确保没有活动性出血。对脑室进行彻底冲洗以清除血块。通常,不放置外部脑室引流管。施罗德教授用明胶海绵填塞颅骨钻孔,并紧密缝合帽状腱膜,以防止帽状腱膜下脑脊液积聚和瘘管形成。皮肤则用连续无创缝线缝合。一般来说,患者会在ICU观察一晚。
INC国际内镜大咖

- 文章标题:脑瘤开颅术后4年复发怎么办?这一次她神经内镜就全切肿瘤!
- 更新时间:2025-06-23 15:02:56

 400-029-0925
400-029-0925