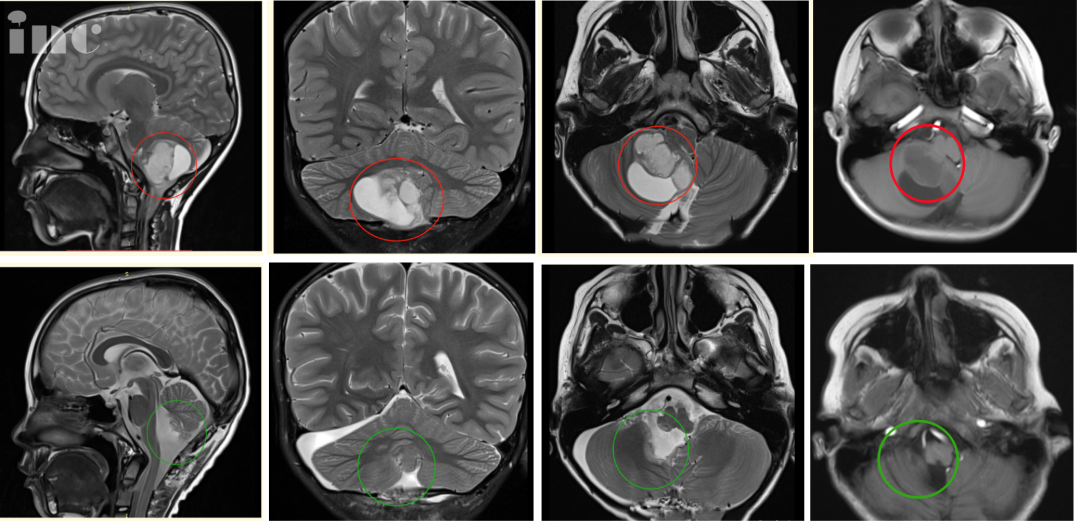
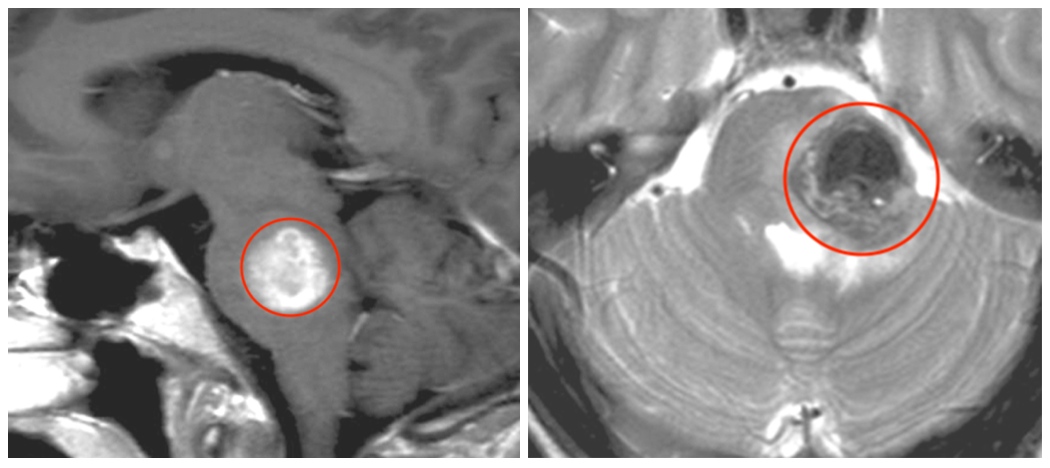
胶质瘤是极为常见的儿童中枢神经系统肿瘤,其中以低级别胶质瘤最为多见,约占儿童神经系统肿瘤的25%-40%。胶质瘤分级是医生判断病情轻重、制定治疗方案和预测预后的关键依据。简单来说,分级就像胶质瘤的“危险程度标签”,揭示了肿瘤细胞的活跃程度——它们长得快不快,是否“不守规矩”(浸润性强),以及未来可能如何发展。与成人不同,儿童神经系统尚处于发育阶段,发生于儿童的胶质瘤具有其独特的分子病理学特征和机制,有时也会成为预后好坏的“暗示”。
胶质瘤分级
国际卫生组织(WHO)制定了胶质瘤的分级标准,主要基于显微镜下观察肿瘤组织的细胞异型性、核分裂象、血管增生及坏死情况等关键特征来进行分级。不同的分级对于儿童预后、生存期来说都截然不同。
01
WHO I级:良性潜力,生长缓慢
特点:肿瘤细胞看起来相对“温和”,很像正常脑细胞;生长极其缓慢;通常有清晰的边界,浸润性很低;通过手术完全切除后,患儿有很高的机会获得长期生存,甚至治愈。中位生存期长达50年。
常见类型:毛细胞星形细胞瘤、室管膜下巨细胞星形细胞瘤等。
治疗及预后:手术是首选的治疗手段。如果手术能完全切除,通常不需要额外的放化疗。术后需要定期影像学复查监测。
02
WHO II级:缓慢浸润
特点:肿瘤细胞已表现出一定的异常(异型性),但生长速度仍然较慢;然而,它们会像水一样悄无声息地浸润到周围的正常脑组织中,术中全切困难,同时,还有恶化为高级别胶质瘤的风险。
常见类型:弥漫性星形细胞瘤、少突胶质细胞瘤、少突星形细胞瘤等。
治疗及预后:手术是基础,目标是尽可能多地安全切除肿瘤。术后根据患儿年龄、肿瘤切除程度、是否存在某些分子标志物(如IDH突变、1p/19q共缺失)等因素,决定是否需要后续放化疗。尽管Ⅱ级胶质瘤的生存率相对较高,中位生存期可达3-5年或更长,但仍存在复发和进展风险。因此,定期随访和监测十分重要。
03
WHO III级:恶性程度中等
特点:肿瘤细胞的异型性更明显,在显微镜下能看到活跃的细胞分裂。生长速度加快,浸润性更强,属于恶性肿瘤。
常见类型:间变性星形细胞瘤、间变性少突胶质细胞瘤、间变性少突星形细胞瘤等。
治疗及预后:手术切除+辅助治疗是标准的疗法。手术仍是重要一步,术后联合放化疗是控制肿瘤生长、延缓复发、延长生存期的关键。但通常具有较差的预后,中位生存期2-4年。
04
WHO IV级:恶性程度高
特点:这是最具侵袭性的原发性恶性脑瘤。肿瘤细胞高度异常,核分裂象极多;在显微镜下能看到特征性的坏死区域和旺盛的新生血管(微血管增生)。生长极其迅速,侵袭性极强。
常见类型:胶质母细胞瘤、弥漫性中线胶质瘤等。
治疗及预后:一般治疗原则为在不损伤神经的前提下,尽可能多地切除强化的病灶,术后辅助放化疗。由于其高度侵袭性,IV级胶质瘤的治疗效果相对有限,中位生存期仅约12-14个月,治疗目标是尽可能控制肿瘤,延长生存期,改善生活质量。
病理报告上的“暗示”
在胶质瘤的治疗中,分子病理检测常常是热点话题。患儿家属最常提出的疑问主要集中在检测的必要性、分子指标的临床意义及其对预后和治疗选择的影响。事实上,读懂分子病理检测报告往往能得到很多信息,提示预后良好还是不良、能为后续用药提供哪些指导等。
▶IDH基因突变:常见于2-3级胶质瘤,尤其是少突胶质细胞瘤。携带该突变的患者不仅预后较好,对化疗也更为敏感,治疗效果相对更好。
▶1p/19q联合缺失:是重要的预后良好标志物。1p/19q染色体臂的不完全或部分缺失不符合少突胶质细胞瘤的诊断标准,但可发生于IDH野生型胶质母细胞瘤病例。提示生长速度较慢,并对丙卡巴肼+洛莫司汀+长春新碱(PCV)联合化疗和替莫唑胺化疗更加敏感,总生存期明显延长。
▶H3 K27突变:H3 K27变异型弥漫性中线胶质瘤(diffuse midline glioma,DMG)最常见的分子改变是H3 p.K28M/I(K27M/I)突变。预后相对较差;但可作为潜在治疗靶点(例如EZH2抑制剂)。
▶MGMT启动子甲基化:在胶质母细胞瘤(GBM)中,若存在该甲基化,意味着肿瘤细胞对替莫唑胺化疗的反应更佳,患者生存期也有望得到延长。
▶TERT突变:与肿瘤侵袭性密切相关,是不良预后的标志,常见于原发性胶质母细胞瘤,这类患者的病情往往进展更快,治疗难度更大。尽管其在IDH野生型胶质瘤中预后较差,但在IDH突变型胶质瘤中预后相对较好。
内容来源:胶质瘤分子病理诊断中国专家共识2025版
- 文章标题:儿童胶质瘤是恶性肿瘤吗?学会读懂病理报告上的这些“暗示”
- 更新时间:2025-11-18 11:05:02

 400-029-0925
400-029-0925